
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 8. Коррозия и защита металлов
Определение и классификация коррозионных процессов Коррозия – это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии. Коррозия – самопроизвольный процесс, поэтому протекает с уменьшением энергии Гиббса системы ( Химическая коррозия характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды. По условиям протекания коррозионного процесса различают: а) газовую коррозию – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах; б) коррозию в неэлектролитах – агрессивных органических жидкостях, таких как сернистая нефть и др. Электрохимическая коррозия характерна для сред, имеющих ионную проводимость. При электрохимической коррозии процесс взаимодействия металла с окислителем включает анодное растворение металла и катодное восстановление окислителя. Электрохимическая коррозия может протекать: а) в электролитах – в водных растворах солей, кислот, щелочей, в морской воде; б) в атмосфере любого влажного газа; в) в почве. Особым видом электрохимической коррозии следует считать коррозию за счет внешнего электрического тока (коррозия трубопроводов с токопроводящими жидкостями, нерастворимых анодов в электрохимических ваннах, подземных металлических сооружений). Хотя механизм протекания коррозионного процесса в разных условиях различен, по характеру разрушения поверхности металла коррозию можно разделить на равномерную и местную (рис. 8.1.).
Особыми видами коррозии являются межкристаллическая коррозия (коррозия по границам зерен), избирательная коррозия (растворение одного из компонентов сплава) и коррозионное растрескивание (коррозия при одновременном воздействии химических реагентов и высоких механических напряжений).
Химическая коррозия Термодинамика химической коррозии. Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например, кислорода, галогенов) при повышенных температурах или в жидкостях неэлектролитах. Рассмотрим химическую коррозию в газах (газовую коррозию), в частности, коррозию в атмосфере кислорода. Уравнение реакции окисления металлов кислородом можно записать в общем виде: nM + m/2O2 = MnOm В соответствии с законами химической термодинамики эта реакция, как и другие реакции коррозии, может протекать лишь при условии уменьшения энергии Гиббса системы. Так как, по определению, энергия Гиббса простых веществ равна нулю, то энергия Гиббса окисления металлов равна энергии Гиббса образования оксидов. Энергию Гиббса реакции окисления рассчитывают по уравнению Δ G = Δ G 0 - где Δ G 0 – стандартная энергия Гиббса реакции; Стандартные значения Δ G 0 приведены в справочниках. Для подавляющего большинства металлов стандартная энергия Гиббса их окисления ниже нуля, что говорит о возможности протекания этой реакции при атмосферном давлении кислорода. Для большинства металлов условие Δ G 0 >0, при котором коррозия невозможна, проявляется при очень низких давлениях кислорода, не реализуемых на практике. Электрохимическая коррозия Механизм электрохимической коррозии. Коррозия металлов в средах, имеющих ионную проводимость, протекает через анодное окисление металла:
и катодное восстановление окислителя.
где
Окислителями при коррозии служат молекулы в нейтральной или щелочной среде:
в кислой среде
и выделение водорода
Кроме электрохимических реакций при коррозии обычно протекают вторичные химические реакции, например взаимодействие ионов металла с гидроксид-ионами, концентрация которых повышается в результате катодных реакций M n + + n OH- = M(OH) n. Как видно, процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Основным отличием процессов электрохимической коррозии от процессов в гальваническом элементе является отсутствие внешней цепи. Электроны в процессе коррозии не выходят из корродирующего металла, а двигаются внутри него. Схема электрохимической коррозии железа в контакте с углеродом приведена на рис. 8.3. На анодных участках происходит реакция окисления железа Fe – 2 e → Fe2+. На катодных участках происходит восстановление водорода 2Н+ + 2 е → Н2. Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микро – а макрогальванопара, и коррозия называется контактной. Сочетания металлов, сильно отличающихся значениями электродных потенциалов, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка. Коррозия металла в результате неравномерного доступа кислорода. Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис. 8.4.).
Рис. 8.4. – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок. Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет катодом. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению. Кислородный электрод. Аналогично водородному электроду можно создать кислородный электрод. Для этого платиновую пластину приводят в контакт с О2 и раствором, содержащими ионы, которые образуются при восстановлении О2 (ионы ОН-):
на кислородном электроде протекает реакция:
потенциал кислородного электрода при 298К описывается уравнением
потенциал водородного электрода описывается уравнением
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 60; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.45.162 (0.01 с.) |
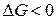 ). По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
). По механизму протекания коррозионного процесса различают химическую и электрохимическую коррозию.
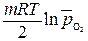 ,
, – относительное парциальное давление кислорода (р /100).
– относительное парциальное давление кислорода (р /100).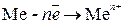
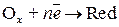 ,
,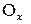 – окислитель;
– окислитель; – восстановленная форма.
– восстановленная форма. , ионы
, ионы  и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода:
и др. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода:


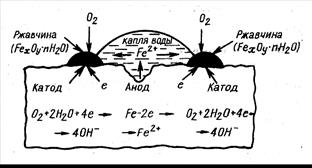 Рис. 8.2. Схема коррозии стали при контакте с водой с поглощением кислорода (атмосферная коррозия)
Рис. 8.2. Схема коррозии стали при контакте с водой с поглощением кислорода (атмосферная коррозия)
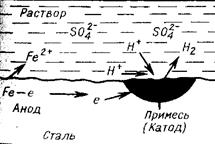 Рис. 8.3. Схема коррозии стали в растворе H2SO4 с выделением водорода
Рис. 8.3. Схема коррозии стали в растворе H2SO4 с выделением водорода

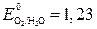 В;
В;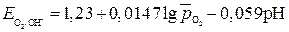 ;
;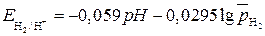 .
.


