
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие металлов с серной кислотойСодержание книги
Поиск на нашем сайте
1. С разбавленной серной кислотой. В разбавленной серной кислоте окислителем являются ионы водорода
2. С концентрированной серной кислотой. В концентрированной серной кислоте окислителем является ион Взаимодействие металлов с серной кислотой можно представить в виде схемы.
Характер взаимодействия зависит от активности металла, условий проведения реакции. Например: при нагревании серной концентрированной кислоты с цинком сначала выделяется сернистый газ, а затем элементарная сера и сероводород.
В одном из уравнений расставим коэффициенты ионно-электронным методом.
Вывод: Окислителем в концентрированной серной кислоте является ион
Концентрированная серная кислота не действует на Сплавы Металлы обладают способностью образовывать друг с другом сплавы. Состав сплавов может изменяться в широких пределах без нарушения их однородности в твердом состоянии. Сплавы могут иметь разную природу. Так, различают сплавы внедрения и сплавы замещения. Образование тех или других обусловлено структурой металлов. Сплавы внедрения. В плотнейшей упаковке сферических атомов (ионов) металлов остаются тетраэдрические и октаэдрические пустоты, причем вторые из них крупнее, чем первые. Если при образовании сплавов атомы элементов занимают пустоты в структуре металла, то образуются сплавы внедрения. Очевидно, состав сплавов внедрения не является постоянным. Сплавы внедрения сохраняют в значительной степени электропроводность и теплопроводность металлов. Но внедрение дополнительных атомов в пустоты структуры создает трудности для скольжения одного слоя ионов металлов относительно другого, благодаря чему сплавы внедрения приобретают твердость. Бориды, карбиды и нитриды металлов, имеющие структуру сплавов внедрения, характеризуются высокими температурами плавления, очень высокой твердостью, химической инертностью. Карбиды железа являются важным компонентом в различных формах стали. При образовании сплавов замещения атомы одного металла замещают атомы другого металла в его позициях в структуре. Такое замещение становится возможным при соблюдении определенных условий: 1. Металлические радиусы атомов не должны различаться более чем на ±15%. 2. Оба металла должны иметь одинаковую структуру, свойственную им в индивидуальном состоянии. 3. Число валентных электронов и химические свойства металлов должны быть одинаковыми. Например, для щелочных металлов образование сплавов замещения возможно для пары K – Rb (различие металлических радиусов 9,3%), но не для пары Na – K (22,0%). Образование сплавов замещения возможно для пары Cu – Au (12,5%). Медь и золото – элементы одной и той же группы IВ и имеют одинаковую структуру (кубическая плотнейшая упаковка). Близость свойств металлов, например Cu и Au, позволяет им смешиваться друг с другом в любых соотношениях. Образуется непрерывный ряд твердых растворов замещения. Но если различие свойств металлов возрастает, то области существования твердых растворов замещения сужаются. Например, сплавы на основе пары металлов Sn – Pb, несмотря на малое различие их металлических радиусов (8%) и размещение в одной группе IVА в периодической системе, различаются своими структурами. Эти сплавы могут включать в себя 2 – 63% Sn, т. е. существуют пределы смешения Sn и Pb. При сильном взаимодействии между металлами образуются химические соединения, называемые интерметаллидами. Основное отличие интерметаллических соединений от твердых растворов замещения – стехиометрический состав. Например, пара металлов Cu – Zn образует интерметаллические соединения следующего состава: CuZn (45-50%), Cu5Zn8 (60-65%), CuZn3 (82-88%). В скобках указано содержание цинка в сплаве, при котором образуются интерметаллические соединения соответствующего состава. Свойства химических соединений существенно отличаются от свойств исходных металлов. Они характеризуются меньшими значениями теплопроводности и электрической проводимости, чем образующие их компоненты. Некоторые интерметаллиды являются даже полупроводниками. Получение металлов Распространенность и состояние металлов в природе. К наиболее распространенным в природе металлам относятся алюминий, железо, кальций, магний и титан. Распространенность их в литосфере (на глубину до 16 км) равна:
Распределение металлов в земной коре может быть равномерным (рассеянные металлы) или неравномерным (в виде месторождений). Небольшая часть металлов может находиться в земной коре в свободном виде (виде простых веществ): платиновые металлы, золото, серебро, ртуть. Остальные элементы находятся в виде химических соединений с другими элементами (в виде минералов). К наиболее распространенным соединениям относятся силикаты (K3AlSi3O8, Kl2(Si3O10)(OH)2Mg3Si4O10H2 и др.), оксиды (Al2O3, Fe2O3, TiO2, Cu2O, CaO и др.), сульфиды (PbS, HgS, FeS2, ZnS, CuS и др.), галогениды (CaF2, NaCl, MgCl2 и др.), карбонаты (CaCO3, MgCO3, FeCO3 и др.), сульфаты (CaSO4, BaSO4, MgSO4 и др.), фосфаты (CaAl6(PO4)4(OH)2·4H2O, Ca3(PO4)2 и др.). Методы получения металлов. Методы получения металлов основываются на разных химических реакциях, что обусловлено разными типами природных минералов, из которых получают металлы, и неодинаковыми химическими и физическими свойствами самих металлов. Методы получения металлов из природных соединений можно разделить на несколько групп: 1. Механическое выделение металлов, находящихся в природе в свободном состоянии. 2. Термическое разложение химических соединений. 3. Вытеснение одного металла из его соединений другим металлом. 4. Электрохимическое восстановление. 5. Методы высокотемпературных химических реакций. Механическое выделение золота из кварцевых пород основано на его высокой плотности (19,3 г/см3). Методы, использующие амальгирование золота ртутью, исключаются из промышленной технологии из-за высокой токсичности ртути. В свободном виде иногда встречаются в природе серебро и платиновые металлы, редко – медь. Эти металлы можно отделять от пустой породы механическими методами. Термическое разложение химических соединений используют как для получения металлов, так и для очистки их от примесей. Некоторые соединения металлов легко разлагаются при нагревании, при этом металлы выделяются в свободном состоянии. К такой группе соединений относятся карбонилы металлов, например, Ni(CO)4. Карбонил никеля получают при 5-150˚С, а разлагают при 230˚С: Ni(к) + 4СО(г) Электрохимическое восстановление металлов проводят как в растворах, так и в расплавах солей. Вытеснение одного металла из его соединения другим металлом, более активным, протекает в соответствии с величинами их электродных потенциалов. Например: Fe(к) + Cu2+(p) → Fe2+(p) + Cu(к). Бедную руду, содержащую CuS, обжигают на воздухе, и образующийся оксид меди переводят в раствор в виде CuSO4. Металлическую медь выделяют из раствора с помощью железного скрапа. Электрохимическое восстановление металлов оуществляется путем электролиза расплавов или растворов их солей. Электролизом расплавов солей получают наиболее активные металлы – Na, K, Mg, Al. При электролизе расплава NaCl на электродах происходят следующие процессы: катод: Na+(ж) + е- → Na(ж) (восстановление), анод: Cl-(ж) → 1/2Cl2(г) + е- (окисление). Электролиз водных растворов солей металлов (CuSO4, NiSO4, CoSO4, CdSO4 и др.) используют преимущественно для электрорафинирования металлов, то есть для получения их в состоянии высокой чистоты. Эти процессы составляют основу гидрометаллургии. Методы высокотемпературных химических реакций составляют основу пирометаллургических процессов. Целью этих процессов является восстановление металлов из их оксидов и некоторых других соединений. В качестве восстановителей используют С (кокс), Н2, Mg, Ca, Al или другие (активные) металлы. Уравнения основных реакций восстановления металлов из их соединений можно представить в упрощенном виде:
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 53; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.156.91 (0.007 с.) |

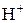 , поэтому она взаимодействует с металлами, расположенными в ряду напряжений до водорода.
, поэтому она взаимодействует с металлами, расположенными в ряду напряжений до водорода.
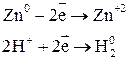
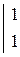
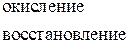
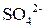 но так как сульфат-ион не является сильным окислителем, то большинство реакций идет при нагревании. Степень окисления серы может меняться от +6 до - 2. Чем активнее металл, тем больше степень восстановления серы.
но так как сульфат-ион не является сильным окислителем, то большинство реакций идет при нагревании. Степень окисления серы может меняться от +6 до - 2. Чем активнее металл, тем больше степень восстановления серы.
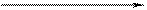
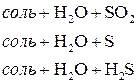

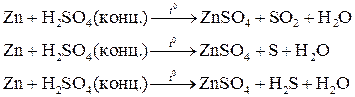
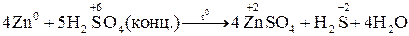
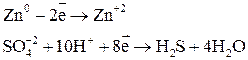
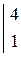
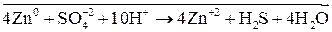
 . Концентрированная серная кислота окисляет многие металлы, в том числе и такие, которые в ряду напряжений расположены правее водорода, при этом обычно выделяется сернистый газ.
. Концентрированная серная кислота окисляет многие металлы, в том числе и такие, которые в ряду напряжений расположены правее водорода, при этом обычно выделяется сернистый газ.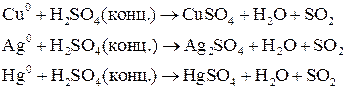
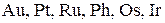 ипассивирует
ипассивирует 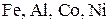 .
. Ni(CO)4(г)
Ni(CO)4(г) 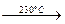 Ni(к) + 4CO(г).
Ni(к) + 4CO(г).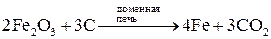 ,
,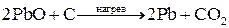 ,
,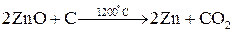 ,
,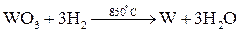 ,
,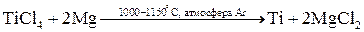 ,
,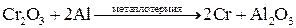 ,
,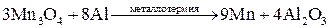 ,
,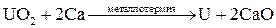 .
.


