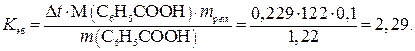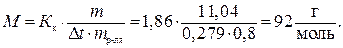Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетические свойства дисперсных систем.
1. Броуновское движение – беспорядочное, хаотичное движение коллоидных и дисперсных частиц. 2. Диффузия – скорость диффузии при постоянной температуре и вязкости среды зависит от величины и формы частиц. Медленность диффузии является признаком, отличающим коллоидные системы от истинных растворов. 3. Седиментацией называется свободное оседание частиц в вязкой среде под действием гравитационного поля. Истинные и коллоидные растворы седиментационно устойчивы. Кинетические свойства коллоидных растворов определяют их кинетическую устойчивость, которая состоит в том, что концентрация коллоидных растворов одинакова по всему объему системы. Решение типовых задач Пример 1. В 450 г воды растворили 50 г Решение. Общая масса раствора составляет 500 г. Процентное содержание кристаллогидрата находим из пропорции:
Процентное содержание безводной соли
где 31,96 – количество граммов Предельную растворимость вещества выражают количеством граммов вещества, которое растворяется в 100 г воды при данной температуре. Очевидно, если предельная растворимость
Если известно, что насыщенный при 40°С раствор 28,57 г соли растворены в 71,43 г воды х » » » » 100»»
Пример 2. Сколько граммов соли и воды содержится в 800 г 12%-ного раствора Решение. Масса растворенной соли составляет 12% от массы раствора, т. е.
а масса растворителя составляет 88% от массы раствора, т.е.
Пример 3. Сколько граммов 3%-ного раствора Решение. В 100 г
безводной соли. Согласно условию задачи масса безводной соли составляет 3% массы раствора. 3% массы раствора составляют 48,84 г 100»» » » х»
Пример 4. Сколько граммов 5%-ного раствора КОН можно приготовить из едкого кали и 100 г воды?
Решение. Согласно условию задачи 100 г воды составляют 95% массы всего раствора. Отсюда масса раствора равна
Пример 5. Сколько граммов Решение. 250 г воды составляют 90 % массы раствора. Масса
Пример 6. В каком количестве граммов воды следует растворить 100 г Решение. 100 г
Следовательно, остается добавить 928 – 51,2 = 876,8 г воды. Можно найти сначала общую массу раствора, которая составит
а затем массу растворителя: 976,8 – 100 = 876,8 г воды.
Пример 7. Сколько граммов 10%-ного раствора H2SO4 требуется для обменного взаимодействия с 100 мл 13,7%-ного раствора Na2CO3 (ρ = 1,145). Решение. Масса 100 мл раствора составляет 114,5 г и содержит 114,5 ∙ 0,137 = 15,68 г Na2CO3. Из уравнения реакции Na2CO3 + H2SO4 = Na2SO4 + CO2 + H2O Находим необходимое количество серной кислоты:
а 10%-ного раствора H2SO4 потребуется
Пример 8. Сколько миллилитров 9,5%-ного раствора Na2CO3 (ρ = 1,10) следует добавить к 100 г воды для получения 3%-ного раствора? Решение. Обозначим искомый объем раствора через x мл. Масса его в этом случае равна х · 1,10 г, а масса содержащегося в нем Na2CO3 равна х ∙ 1,10 · 0,095 г. Согласно уравнению задачи, масса растворенного вещества составляет 3% от массы полученного раствора (1,10 х + 100):
х ≈ 42 мл.
Пример 9. Сколько мл 35%-ного раствора аммиака (ρ = 0,94) требуется для образования 33г (NH4)2SO4? Решение. Из уравнения реакции 2NH3 + H2SO4 = (NH4)2SO4 находим массу аммиака:
а 35%-ного раствора потребуется
Пример 10. Сколько мл 32,5%-ного раствора NH3 (ρ = 0,888) требуется для образования сульфата аммония (NH4)2SO4 с 250 мл 27,3%-ного раствора H2SO4 (ρ = 1,2)? Решение. Масса раствора кислоты составляет 250 ∙ 1,2 = 300 г. Раствор содержит 300 · 0,273 = 81,9 г H2SO4 . Согласно уравнению 2NH3 + H2SO4 = (NH4)2SO4 вычисляем массу аммиака, вошедшего в реакцию; она составляет
Этому количеству граммов NH3 соответствует
или
его 32,5%-ного раствора.
Пример 11. Вычислить молярную концентрацию, молярную концентрацию эквивалента, титр и моляльность 10% - го раствора Al2(SO4)3 (ρ = 1,105 г/см3). Решение. 1. Масса 1 л раствора тр-ра = ρ V р-ра = 1,105 ∙1000 =115 г. По определению массовой доли, в 100 г раствора содержится 10 г Al2(SO4)3, следовательно, в 1105 г (т. е. в 1 л) соответственно (1105 ·10)/100 = 110,5 г. Молярная масса Al2(SO4)3 М(Al2(SO4)3) = 342 г/моль. Таким образом, в 1 л раствора содержится 110,5/342 = 0,32 моль Al2(SO4)3 и молярная концентрация раствора см равна 0,32 моль/л. 2. Эквивалент молекулы Al2(SO4)3 равен 1/6 молекулы: Э(Al2(SO4)3) = 1/6 (М(Al2(SO4)3)). Следовательно, в одном моле Al2(SO4)3 содержится шесть моль-эквивалентов, а в 1 л данного раствора 0,32 · 6 = 1,92 моль-экв Al2(SO4)3. Молярная концентрация эквивалента (или нормальная концентрация) сн равна 1,92 моль/л или 1,92 н. 3. Поскольку выше было найдено, что в 1000 мл раствора содержится 110,5 г растворенного вещества, то в 1 мл находится 110,5/1000 = 0,1105 г Al2(SO4)3 и титр раствора Т = 0,1105 г/мл. 4. По условию в 100 г раствора содержится 10 г Al2(SO4)3 и 90 г Н2О. Тогда на 1000 г воды приходится (1000 · 10)/90 = 111,11 г Al2(SO4)3. Это составляет 111,11/342 = 0,325 моль. Следовательно, в 1000 г растворителя содержится 0,325 моль растворенного вещества Al2(SO4)3 и моляльность раствора ст,по определению, равна 0,325 моль/1000 г Н2О. Пример 12. Константа диссоциации муравьиной кислоты НСООН, диссоциирующей по уравнению
составляет Решение.
что соответствует 2,64 %
Вариант решения. Напишем выражение для константы диссоциации в общем виде:
Числитель представляет собой произведение концентраций ионов; эти концентрации равны друг другу, поэтому числитель можно заменить выражением
Находим
Пример 13. Концентрация гидроксильных ионов Решение.
Или, если
Пример 14. рН раствора составляет 4,3. Вычислить Решение.
0,7 – это логарифм коэффициента, стоящего при 10-5. Этому логарифму соответствует число 5, следовательно,
Соотношение между
Для вычисления рН растворов кислот и оснований следует предварительно вычислить Пример 15. Вычислить рН 1/400 М раствора КОН. Решение. Принимая, что активность иона ОН- практически равна его концентрации, находим
рН = 14 – 2,6 = 11,4.
Пример 16. Вычислить рН 1%-ного раствора муравьиной кислоты, считая, что плотность раствора равна 1; Решение. 1 л раствора содержит 10 г НСООН, что составляет
Пример 17. Определите температуру кипения раствора, содержащего 1,84г нитробензола C6N5NO2 в 10 г бензола. Эбуллиоскопическая постоянная бензола 2,53. Температура кипения чистого бензола 80,20С.
Решение. По закону Рауля
Температура кипения раствора:
Пример 18. Раствор, содержащий 1,22 г бензойной кислоты C6H5COOH в 100 г сероуглерода, кипит при 46,529 0С, температура кипения сероуглерода 46,3 0С. Вычислите эбуллиоскопическую константу сероуглерода. Решение. Повышение температуры кипения ∆t = 46,529 – 46,3 = 0,2290. Молярная масса бензойной кислоты 122 г/моль. Из формулы (1) находим эбуллиоскопическую константу:
Пример 19. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при –0,2790C. Вычислить молярную массу глицерина. Решение. Температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации ∆t = 0 – (– 0,279) = 0,2790. Подставляя в уравнение (1) данные вычисляем молярную массу глицерина:
5.10. Задачи для самостоятельного решения
1. Для борьбы с вредителями растений приготовлен раствор 50 г BaCl2 2H2O на 1 л воды. Вычислите процентное содержание соли BaCl2 в этом растворе. 2.Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна концентрация оставшегося раствора? 3. Смешали 300 г 20 %-ного раствора и 500 г 40 %-ного раствора NaCl. Чему равна массовая доля полученного раствора? 4. Имея в виду реакции полной нейтрализации, вычислить молярные массы эквивалентов следующих веществ: а) HNO3; б) H2SO4; в) Ba(OH)2; г) Na2B4O7. 5. Вычислите: а) массовую долю (ω, %); б) молярную (С, моль/л), в) молярную концентрацию эквивалента (С(1/z, А)); г) моляльную (Сm) концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 мл воды, если плотность его 1,031 г/мл. Чему равен титр (Т, г/мл) этого раствора? 6. На нейтрализацию 50 мл раствора кислоты израсходовано 25 мл 0,5н. раствора щелочи. Чему равна молярная концентрация эквивалента кислоты? 7. На нейтрализацию 31мл 0,16н. раствора щелочи требуется 217 мл H2SO4. Чему равны молярная концентрация эквивалента и титр раствора H2SO4? 8. Сколько граммов (NH4)2SO4 нужно взять для приготовления 2 мл 0,05 М раствора? Какова молярная концентрация эквивалента такого раствора? 9. Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296оС. Температура кристаллизации бензола 5,5оС. Криоскопическая константа 5,1о. Вычислите молярную массу растворенного вещества.
12.Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) КНСО3 и Н2SО4; б) Zn(OH)2 и NaOH; в) СаСl2 и AgNO3. 13. Какое из веществ: КНСО3, СН3СООН, NiSO4, Na2S – взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. 14. Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, KCl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (>7<) имеют растворы этих солей? 15.Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, KCl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (>7<) имеют растворы этих солей? 16. Концентрация ионов Н+ при стандартной температуре равна 2 ∙ 10-4 моль/л. Вычислить концентрацию ионов ОН-, рН и рОН в этом растворе. 17. Вычислить концентрацию ионов ОН- в растворе, рН которого 5,25. 18.Вычислить рН раствора азотной кислоты, если массовая доля кислоты в растворе 4% (ρ = 1,02 г/мл). 19. Вычислить рН раствора, в 500 мл которого растворено 2 г NaOH. 20. Определите концентрацию ионов ОН- в 0,01 М NH4OH (Кд = 1,8 ·10-5). Рассчитайте рН этого раствора при 295 К.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.131.178 (0.103 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 . Вычислить процентное содержание кристаллогидрата и безводной соли.
. Вычислить процентное содержание кристаллогидрата и безводной соли.
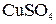 составит
составит ,
, при 0°С составляет 27,6 г, то насыщенный при указанной температуре раствор содержит
при 0°С составляет 27,6 г, то насыщенный при указанной температуре раствор содержит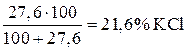 .
.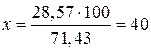 г соли.
г соли. ?
? г
г  г воды.
г воды. можно приготовить из 100 г
можно приготовить из 100 г 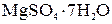 ?
?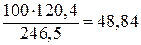 г
г г.
г. г.
г.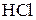 следует растворить в 250 г воды для получения 10%-ного раствора
следует растворить в 250 г воды для получения 10%-ного раствора  г
г 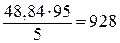 г.
г. г,
г,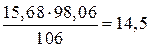 г,
г,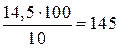 г.
г.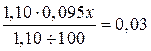 ,
,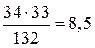 г,
г, г, или
г, или  мл.
мл. г NH3.
г NH3. г
г мл
мл
 . Вычислить a и
. Вычислить a и  для 0,3 М раствора этой кислоты.
для 0,3 М раствора этой кислоты.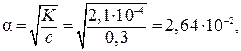
 моль/л;
моль/л; .
. . Знаменатель представляет собой концентрацию недиссоциированной части кислоты, которую, если пренебречь диссоциированной частью, примем равной общей концентрации электролита (то же допущение делается и при выводе формулы
. Знаменатель представляет собой концентрацию недиссоциированной части кислоты, которую, если пренебречь диссоциированной частью, примем равной общей концентрации электролита (то же допущение делается и при выводе формулы 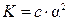 , когда величина 1 - a принимается равной 1). В этом случае
, когда величина 1 - a принимается равной 1). В этом случае
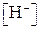 :
: моль/л;
моль/л;
 моль/л. Вычислить рН.
моль/л. Вычислить рН.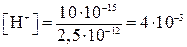 моль/л,
моль/л,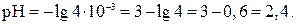
 Учитывая, что рН + рОН = 14, находим рН = 14 – 11,6 = 2,4.
Учитывая, что рН + рОН = 14, находим рН = 14 – 11,6 = 2,4. .
.
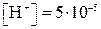 моль/л, а
моль/л, а  моль/л.
моль/л. рН и рОН
рН и рОН
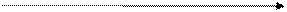
 или
или 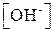 .
.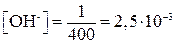 моль/л;
моль/л;

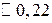 моль/л.
моль/л.
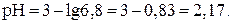
 , (17)
, (17)