
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 6. Окислительно-восстановительные электрохимические процессы
Окислительно-восстановительные процессы относятся к числу распространенных химических реакций. Дыхание, усвоение СО2 растениями с выделением О2, обмен веществ и ряд биологических процессов в основе своей имеют окислительно-восстановительные реакции. Сжигание топлива в двигателях внутреннего сгорания, электролитическое осаждение металлов, процессы, происходящие в гальванических элементах и аккумуляторах, включают реакции окисления-восстановления. Получение металлов, простых веществ, ценных химических продуктов (аммиака, щелочей, HNO3,H2SO4), производство строительных материалов, пластмасс, медикаментов основано на окислительно-восстановительных процессах. Основные понятия Реакции, в результате которых изменяются степени окисления элементов, называются окислительно-восстановительными. Например,
Любая окислительно-восстановительная реакция состоит из двух процессов, или полуреакций: окисления и восстановления. Реакция окисление цинка и восстановление водорода Вещества, входящие в полуреакцию, образуют сопряженную пару. Один из их компонентов называют окисленной формой – Ох, другой – восстановленной формой – Red. O x Red O x Red Окисленная форма образована элементом в более высокой степени окисления, восстановленная форма – элементом в более низкой степени окисления. Степень окисления изменяется у Zn от 0 до +2, у водорода от +1 до 0. Продуктами реакции являются новые окислитель и восстановитель, более слабые, чем исходные:
O x 1 + Red2 → O x 1 + Red2 Окисление – это процесс отдачи электронов атомом, молекулой или ионом.
Атом, молекула или ион, отдающий электроны называется восстановителем. Восстановление – процесс присоединения электронов атомом, молекулой, ионом
Атом, молекула или ион, принимающий электроны называется окислителем. В большинстве случаев происходит не перенос электронов, а смещение электронного облака, поэтому правильнее говорить об изменении электронной плотности. Степень окисления – это условно приписываемые заряды, которые могут приобрести атомы элемента, если бы они отдали или присоединили некоторое число электронов.
Степень окисления может иметь положительное, нулевое и отрицательное значение. Величина положительной степени окисления определяется числом электронов, оттянутых от данного атома. Обозначается «+». Отрицательная степень окисления приписывается атомом, притянувшим к себе электроны равной числу притянутых электронов и обозначается «–».
Правила определения степени окисления
1. Атомы кислорода имеют степень окисления «-2», за исключением окиси фтора О+2F2 и пероксидов 2. Атомы водорода во всех соединениях имеют степень окисления «+1» за исключением гидридов металла (Li+H-). 3. Степень окисления элемента в простом веществе (О2, Н2, Na, C) равна нулю. 4. Степень окисления атомов в ионных соединениях для данного иона равна по знаку и величине его электрическому заряду 5. В соединениях с ковалентной полярной связью, атомы элементов с большей величиной электроотрицательности имеют «–» степень окисления, а с меньшей электроотрицательностью «+» степень окисления.
6. Степень окисления атомов в органических соединениях, определяется также, как и в ковалентно-полярных соединениях. 7. Алгебраическая сумма степеней окисления элементов в нейтральной молекуле равна нулю, в сложном ионе – заряду иона.
Различают 3 типа окислительно-восстановительных реакций: 1. Межмолекулярные – к ним относятся реакции, в которых окислитель и восстановитель находятся в разных веществах (например, рассмотренная выше реакция); 2. Внутримолекулярные – реакции, в которых окислитель и восстановитель находятся в одном и том же веществе, например в реакциях термического разложения:
4. Диспропорционирования – реакции, в которых участвуют молекулы, атомы, ионы, проявляющие и окислительные, и восстановительные свойства:
|
|||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 78; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.150.59 (0.005 с.) |
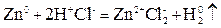 .
. состоит из двух полуреакций:
состоит из двух полуреакций: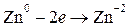
 .
.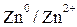 ;
; 

 .
.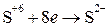 ;
;  ;
;  .
.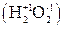 .
.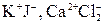 .
.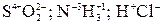 .
.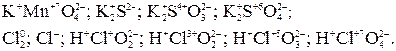

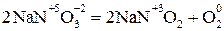
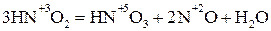 .
.


