
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа № 26. измерение скорости разложения пероксида водорода газометрическим методомСодержание книги
Похожие статьи вашей тематики
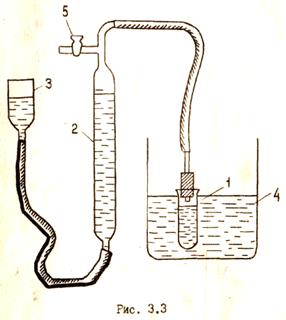
Поиск на нашем сайте Цель работы − определение основных кинетических параметров химической реакции: средней константы скорости, порядка реакции и энергии активации. Ознакомление с газометрическим методом изучения кинетики химических реакций, протекающих с участием газообразных веществ. Пероксид водорода в водных растворах самопроизвольно разлагается по уравнению с выделением газообразного кислорода 2Н2О2 →2Н2О + О2. В присутствии некоторых катионов и анионов разложение заметно ускоряется. Реакция может служить примером гомогенной каталитической реакции. Разложение Н2О2сопровождается выделением О2. За ходом реакции следят по изменениям объема выделившегося кислорода через различные промежутки времени от начала реакции. Схема прибора для изучения кинетики разложения пероксида водорода представлена на рис. 3.3. Порядок выполнения работы 1. Налить в реакционный сосуд (1) раствор катализатора и при открытом кране (5) поместить сосуд в термостат (4). Вид катализатора и температурный режим процесса определяется преподавателем. 2. С помощью уравнительного сосуда (3) установить уровень воды в бюретке (2) на нулевом делении или около него. Закрыть кран (5) и проверить прибор на герметичность. 3. Выдержать реакционный сосуд в термостате ~20 мин. и влить в него по указанию преподавателя определенное количество пероксида водорода. Раствор перемешать, встряхивая реакционный сосуд с закрытой пробкой. кран вверху бюретки держать открытым 1 мин. для вытеснения воздуха, затем его закрыть. 4. Установить на одной отметке уровни жидкости в бюретке (2)и в уравнительном сосуде (3), чтобы привести давление в приборе к атмосферному. Записать исходный уровень жидкости в бюретке и время на часах. 5. В ходе реакции делать замеры уровня жидкости в измерительной бюретке через каждые 2-3 мин. в течение 30-36 мин. Следить, чтобы при измерениях уровни жидкости в бюретке и уравнительном сосуде были одинаковыми. 6. После того как реакция практически прекратится, реакционный сосуд поместить в кипящую водяную баню на 15 мин. При кипячении на водяной бане уравнительный сосуд поддерживать в самом высоком положении. 7. Охладить реакционный сосуд до температуры термостата, выдержать в течение 10-15 мин., после чего замерить уровень жидкости в бюретке (α∞). 8. Результаты измерений занести в таблицу, записав следующие условия опыта: Температура опыта …………………………………………... Катализатор…………………………………………………… Количество Н2О2………………………………………………
9. Построить кинетическую кривую αt = f(τ). 10. Рассчитать константу скорости для трех-четырех измерений τ при установившемся режиме (в середине процесса) по кинетическому уравнению первого порядка, где концентрации пероксида водорода заменить пропорциональными им величинами объемов выделившегося кислорода. Следует считать, что максимальный объем выделившегося кислорода пропорционален начальной концентрации пероксида водорода, а объем α∞- ατ пропорционален изменению концентрации пероксида водорода к моменту от начала реакции. Тогда
11. Вычислить среднее значение константы скорости реакции. 12. Построить график зависимости tg(α∞-αt) = f(τ), откладывая время в минутах по оси абсцисс. Для реакции первого порядка эта зависимость выражается прямой, тангенс угла наклона которой к оси τесть константа скорости. 13. Определить константу скорости по графику и сравнить с вычисленной. С учетом перевода натурального логарифма в десятичный k = 2,3 tgφ. 14. Записать уравнение химической реакции разложения пероксида водорода и кинетическое уравнение реакции. 15. Получив у преподавателя значение константы скорости при другой температуре, рассчитать энергию активации реакции.
|
|||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 1206; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.01 с.) |

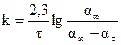 .
.


