
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон Гесса. Термохимические расчеты
Тепловые эффекты химических реакций и фазовых превращений изучает термохимия. Уравнение химической реакции с указанием теплового эффекта называется термохимическим уравнением. В таком уравнении символы реагентов сопровождаются указанием их агрегатного состояния. Основной закон термохимии сформулирован русским ученым Г.И. Гессом: «Тепловой эффект химической реакции, протекающей при постоянном давлении или постоянном объеме, не зависит от пути реакции, а зависит только от природы исходных и конечных веществ и их состояний». Если система переходит из состояния 1 в состояние 2, то для p = const и v = const можно записать:
QP = ∆Н1,2 = Н2 – Н1 = Qv = ∆U1,2 = U2 – U1 =
где Значения тепловых эффектов и величины термодинамических функций обычно относят к стандартному состоянию веществ. В качестве стандартного состояния индивидуальных жидких и твердых веществ принимают наиболее устойчивое состояние их при давлении 1 атм., данной температуре и концентрации 1 моль/л, а для индивидуальных газов – такое их состояние, когда при данной температуре и собственном давлении I атм. они обладают свойствами идеальных газов. При расчете тепловых эффектов химических реакций на основе закона Гесса особое значение имеют два вида тепловых эффектов – теплота образования и теплота сгорания. Их называют также энтальпией образования и энтальпией сгорания, понимая под этим изменение энтальпии в указанных реакциях. Теплотой образования называется тепловой эффект реакции образования одного моля данного соединения из простых веществ, отвечающих наиболее устойчивому состоянию рассматриваемого элемента при данной температуре. Теплоту образования одного моля соединения при давлении 1013 ГПа (1 атм) называют стандартной теплотой образования ∆f Н0. В справочниках значение этой величины дается для температуры 298 К и обозначается
Теплотой сгорания называется тепловой эффект реакции полного сгорания данного соединения в чистом кислороде до наивысших оксидов элементов, входящих в состав сложного соединения − углекислого газа, водяных паров и других соединений. Из закона Гесса вытекает ряд важных следствий, применение которых упрощает многие термохимические расчеты. Основные из них: 1. Тепловой эффект химической реакции равен разности алгебраических сумм теплот образования продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов: где индекс i относится к исходным веществам, а индекс j– к продуктам реакции.
2.Тепловой эффект химической реакции равен разности алгебраических сумм теплот сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов.
Значения стандартных теплот образования и теплот сгорания веществ имеются в таблицах термохимических величин. Для расчета тепловых эффектов реакций при температурах, отличных от 298 К, пользуются уравнением Кирхгофа: где
Второй закон термодинамики Второй закон термодинамики позволяет определить возможность протекания и направление процесса в изолированных системах при данных условиях. Для изолированных систем критерием, который характеризует возможность, направление и предел самопроизвольного протекания термодинамических процессов, служит особая функция состояния – энтропия S. Энтропия является мерой вероятности состояния системы. Она возрастает при переходе вещества из более упорядоченного состояния в менее упорядоченное, например при переходе вещества из кристаллического состояния в жидкое и из жидкого в газообразное, при растворении кристаллов, при расширении газов. Все процессы, в результате которых упорядоченность системы возрастает, сопровождаются уменьшением энтропии.
Согласно второму закону термодинамики в изолированных системах могут совершаться только такие процессы, при которых энтропия системы возрастает, и подобный самопроизвольный процесс может идти только до такого состояния, при котором энтропия обладает максимальным значением (для данных условий). Изменение энтропии при обратимом превращении и постоянной температуре может быть выражено уравнением Обратимым превращением является бесконечно медленный переход системы из одного равновесного состояния в другое через непрерывный ряд равновесных состояний. При обратимом протекании процесса система все время находится в состоянии термодинамического равновесия, когда значения ее параметров в каждый момент одинаковы в любой точке и не меняются во времени. Для необратимых процессов
Самопроизвольно протекающие процессы необратимы, т.е. систему нельзя вернуть в исходное состояние, не производя каких-либо изменений в ней самой или в окружающей среде. Поскольку энтропия – функция состояния, ее изменение не зависит от того, как протекает процесс: обратимо или необратимо. Из (1.11) и (1.12) следует, что В изолированной системе Изменение энтропии в химических процессах вычисляется так же, как и изменение любой функции состояния:
В отличие от энтальпии образования энтропия простого вещества не равна нулю. На практике чаще всего имеют дело с закрытыми системами, которые обмениваются с внешней средой энергией, но не обмениваются веществом. Для такой реальной системы, находящейся при постоянной температуре и давлении, критерием направленности процесса является функция состояния, называемая изобарно-изотермическим потенциалом, или энергией Гиббса, и определяемая по уравнению ∆G = ∆H - T∆S. (1.14) Для изобарно-изотермических процессов условием равновесия будет ∆G = 0. Условием самопроизвольного протекания процесса − ∆G < 0. При ∆G > 0 реагенты не могут превращаться в продукты, а принципиально возможна обратная реакция – превращение продуктов в реагенты. Стандартный изобарно-изотермический потенциал образования соединения
Вопросы и задачи к главе 1 1. Что такое термодинамическая система? Какие вы знаете типы систем? 2. В чем сущность первого закона термодинамики? 3. Чему равен тепловой эффект изобарного и изохорного процессов? 4. Как формулируется закон Гесса и какие следствия из него вытекают? 5. Что такое функции состояния? 6. Что называется стандартной теплотой образования и сгорания? 7. В чем сущность второго закона термодинамики? 8. Что такое термодинамически обратимые и необратимые процессы? 9. Каков физический смысл энтропии? 10. Что такое изобарно-изотермический потенциал и как его можно вычислить? 11. Пользуясь теплотами образования, рассчитайте тепловой эффект следующих реакций в стандартных условиях: CO(r) + H2O(r) = CO2(r) + H2(r); Fl2O3(k) + 2Al(k) = Al2O3(k) + 2Fl(k). CO(r) - 110,6 H2O(r) - 241,98 CO2(r) - 393,8 Fl2O3(k) - 822,7 Al2O3(k) - 1676,8 Ответ: - 41,2 кДж, - 854,1 кДж. Рассчитайте 3H2(r) + N2(r) = 2NH3(r)
Ответ: - 206,8 кДж/моль град Рассчитайте изменение энтальпии, энтропии и энергии Гиббса для реакции окисления NO в NO2 в стандартных условиях; 2NO + О2 = 2NO2 NO 90,31 NO 210,7 NO2 33,00 NO2 240,2 O2 0 O2 205,0 Ответ:
|
|||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 260; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.28.197 (0.021 с.) |
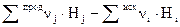 ; (1.6)
; (1.6)  , (1.7)
, (1.7) 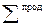 − сумма соответствующих величин для продуктов реакции;
− сумма соответствующих величин для продуктов реакции; 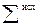 − сумма соответствующих величин для исходных веществ; νi и νj – стехиометрические коэффициенты соответственно перед исходными веществами и продуктами реакции в уравнении.
− сумма соответствующих величин для исходных веществ; νi и νj – стехиометрические коэффициенты соответственно перед исходными веществами и продуктами реакции в уравнении.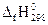 . Теплота образования простых веществ принята равной нулю.
. Теплота образования простых веществ принята равной нулю.
 , (1.8)
, (1.8)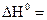
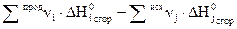 . (1..9)
. (1..9)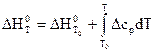 , (1.10)
, (1.10)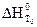 – тепловой эффект химической реакции при температуре Т0 (298 К);
– тепловой эффект химической реакции при температуре Т0 (298 К); 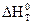 – тепловой эффект при любой температуре Т;
– тепловой эффект при любой температуре Т;  – разность молярных изобарных теплоемкостей продуктов и исходных веществ с учетом стехиометрических коэффициентов:
– разность молярных изобарных теплоемкостей продуктов и исходных веществ с учетом стехиометрических коэффициентов: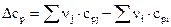 .
.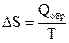 . (1.11)
. (1.11)
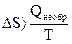 . (1.12)
. (1.12) 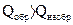 .
.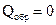 и
и 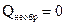 . Из этого следует, что в изолированной системе при обратимом протекании процесса
. Из этого следует, что в изолированной системе при обратимом протекании процесса 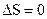 , а при необратимом
, а при необратимом 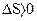 . Процессы с уменьшением энтропии, когда
. Процессы с уменьшением энтропии, когда 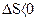 , в такой системе невозможны. Таким образом, энтропия является критерием направленности протекания процессов для изолированной системы. Процесс протекает самопроизвольно, если
, в такой системе невозможны. Таким образом, энтропия является критерием направленности протекания процессов для изолированной системы. Процесс протекает самопроизвольно, если 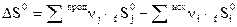 (1.13)
(1.13)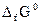 равен изменению изобарного потенциала при реакциях образования этого соединения из простых веществ в стандартных условиях (р = 1013 ГПа, Т = 298 К). Величину
равен изменению изобарного потенциала при реакциях образования этого соединения из простых веществ в стандартных условиях (р = 1013 ГПа, Т = 298 К). Величину  можно вычислить из табличных значений
можно вычислить из табличных значений 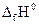 и
и 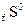 участников реакции. Свободную энергию Гиббса химической реакции, которая определяет возможность протекания любого химического превращения в стандартных условиях, можно рассчитать по уравнению
участников реакции. Свободную энергию Гиббса химической реакции, которая определяет возможность протекания любого химического превращения в стандартных условиях, можно рассчитать по уравнению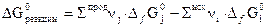 . (1.15)
. (1.15)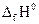 (кДж/моль);
(кДж/моль);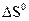 следующей реакции:
следующей реакции: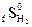 = 130,7 Дж/моль град
= 130,7 Дж/моль град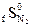 = 199,9 Дж/моль град
= 199,9 Дж/моль град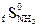 = 238,36 Дж/моль град
= 238,36 Дж/моль град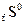 , кДж/ моль∙К
, кДж/ моль∙К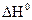 = - 56,8 кДж/ моль;
= - 56,8 кДж/ моль; 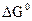 = - 29,0 кДж/ моль.
= - 29,0 кДж/ моль.


