
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт № 2. Нейтрализация серной кислоты в две стадии.
1.Вытереть досуха фильтровальной бумагой внутренний стакан калориметра и мешалку. 2. В стакан налить точно 200 мл 0,4 н раствора серной кислоты из мерного цилиндра. 3. Измерить температуру раствора кислоты Т0. 4. Наполнить бюретку 2 н раствором щелочи и налить из нее в стакан 20 мл раствора щелочи, непрерывно перемешивая раствор в стакане. 5. Записать максимальную температуру после прохождения реакции Т1. 6. Сразу же добавить еще 20 мл щелочи из бюретки и заметить вторую максимальную температуру Т2. 7. Вычислить разность температур для каждой стадии (Т1-Т0) и (Т2-Т1) и суммарную разность. Сравнить ее с величиной, полученной в опыте 1. 8. Написать уравнение реакции по стадиям и суммарное уравнение. 9. Сделать выводы.
Работа № 21. ТЕРМОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Цельработы – использование термохимических измерений в аналитических целях для определения концентрации щелочи по тепловому эффекту реакции нейтрализации.
Титрованием называется метод определения концентраций одного вещества при помощи раствора другого вещества с известной концентрацией (титрованного раствора). Пользуясь титрованным раствором кислоты, можно определить концентрацию раствора щелочи. Для этого надо найти объемы растворов щелочи и кислоты, в которых количества последних эквивалентны между собой. Так как большинство химических реакций сопровождается определенным тепловым эффектом, то прибавление одного реагента к другому приводит к изменению температуры реакционной смеси. Температура будет меняться до тех пор, пока вещества не прореагируют полностью. При дальнейшем прибавлении одного из реагентов температура либо остается постоянной, либо незначительно изменится за счет теплообмена с окружающей средой. В связи с этим на графике, отражающем изменение температуры в зависимости от количества прибавляемого реагента, появится точка перегиба, соответствующая точке эквивалентности. В этой точке вещества находятся в эквивалентных соотношениях. Применив закон эквивалентов, можно рассчитать концентрацию одного из реагентов, если концентрация другого известна:
где NB, VB − нормальность и объем титрующего раствора; NA, VA − нормальность и объем раствора с неизвестной концентрацией. Таким способом можно и удобно титровать цветные, мутные и многокомпонентные растворы при проведении количественного анализа.
Оборудование 1. Калориметр (рис. 1.1). 2. Бюретка. Порядок выполнения работы 1. Налить во внутренний стакан калориметра 40 мл титруемого раствора щелочи. 2. Опустить в раствор стеклянную мешалку и термометр Бекмана. 3. В течение 2-3 минут наблюдать за температурой, которая практически не должна измениться. 4. Опустить в калориметр кончик бюретки с титрующим раствором кислоты так, чтобы раствор из нее не попадал на термометр. 5. Приливать титрующий раствор к титруемому непрерывно и с постоянной скоростью, все время размешивая мешалкой. Записывать показания термометра Бекмана после каждого прилитого миллилитра. 6. На основании полученных данных построить график в координатах «температура − объем титрующего раствора в миллилитрах». 7. По перегибу кривой приближенно определить точку эквивалентности (обычно она лежит в интервале объемов 3-8 мл). 8. Провести по вышеописанной методике точный опыт, при котором записывать температуру через каждые 0,5 мл прилитого раствора кислоты. 9. Результаты нанести на график и уже точно определить точку эквивалентности. 10. Рассчитать концентрацию раствора щелочи.
ГЛАВА 2. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Состояние химического равновесия определяется двумя признаками: ● если система находится в состоянии равновесия, то состав ее с течением времени при постоянных внешних условиях не изменяется; ● если система, находящаяся в равновесии, будет выведена из этого состояния вследствие внешних воздействий, то с прекращением их действий она возвратится в прежнее состояние. Химическое равновесие наступает в том случае, когда энтропия достигает максимума (для изолированных систем) или изобарно-изотермический потенциал – минимума (для открытых систем).
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 242; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.157.45 (0.006 с.) |
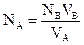 ,
,


