
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа № 22. Определение давления насыщенного пара и теплоты испарения чистого веществаСодержание книги
Поиск на нашем сайте
Цель работы − расчет теплоты испарения чистого вещества.
Давление насыщенного пара над чистыми жидкостями, теплота их испарения и температура связаны уравнением Клайперона−Клаузиуса:
где ΔНисп − мольная теплота парообразования (изменение энтальпии); ΔV− разность мольных объемов пара и жидкости. Используя уравнение Менделеева−Клапейрона уравнение (2.12) легко преобразовать к виду
После интегрирования в пределах температур T1 – Т2получаем Таким образом, для вычисления теплоты испарения необходимо измерить давление насыщенного пара при двух температурах Т1 и Т2. В данной работе давление насыщенного пара определяется методом уноса пара инертным газом. Сущность метода заключается в следующем: через испытуемую жидкость, находящуюся при постоянной температуре, медленно пропускается газ (не растворяющийся в данной жидкости и не взаимодействующий с ней), при этом газ насыщается парами вещества и увлекает его из сосуда. По объему пропущенного газа V, количеству исследуемого вещества, перешедшего в пар g, и молекулярной массе вещества М определяют давление насыщенного пара вещества при данной температуре. Определение давления насыщенного пара при двух температурах позволяет рассчитать теплоту испарения. Опыт осуществляется на установке, схема которой приведена на рис. 2.3.
Рис. 2.3
Сосуд для испарения (9) помещают в термостат (8), где поочередно поддерживаются две различные температуры, измеряемые термометром (6), при которых определяют давление насыщенного пара. Инертным газом служит сухой воздух, который вытесняется из газометра (1) водой, поступающей в него через воронку (3) при открывании крана (2). Воздух осушается в процессе прохождения через колонку с хлористым кальцием (11), поставленную на пути от газометра к сосуду (9). Сосуд с помощью резиновой трубки (10) соединяется с осушительной колонкой − тубусом (5), через который воздух поступает в сосуд (не путать с тубусом 7, через который воздух покидает его!). Объем пропускаемого воздуха V определяется объемом воды, наливаемой в воронку. Воздух должен проходить через систему медленно, чтобы обеспечивалось полное его насыщение испытуемым веществом. Это насыщение достигается при условии, если скорость воздуха не превышает 2л/час, что соответствует прохождению примерно 120 пузырьков воздуха в минуту через прибор (9). Скорость воздуха регулируется краном (4). Сопротивление, оказываемое всей системой проходящему через нее воздуху, определяет необходимость создания в газометре некоторого избыточного (по отношению к атмосферному) давления Количество испарившегося вещества определяют по разности масс сосуда (9) с веществом до и после эксперимента. Внешнее давление ризмеряется ртутным барометром в начале эксперимента и показание его проверяется в конце эксперимента. В показание барометра вносится поправка на температуру. Значение температурных поправок Порядок выполнения работы
1. Взвесить сосуд (9) с исследуемым веществом (этиловый спирт, серный эфир) на аналитических весах (тубусы 5 и 7 должны быть закрыты пробками). 2. Собрать установку по приведенной схеме и погрузить сосуд в термостат. 3. Измерить температуру в термостате и атмосферное давление р. 4. При закрытом кране (2) влить в воронку 3,5 л воды (объем определить мерным цилиндром). 5. Открыть кран (2) и, отрегулировав скорость тока воздуха краном (4), следить за вытеканием воды из воронки (3). 6. Измерить избыточное давление 7. Когда вода из воронки (3) вытечет, закрыть кран (2), подождать, пока не окончится прохождение пузырьков воздуха через сосуд (9), извлечь его, закрыть тубусы пробками, вытереть фильтровальной бумагой и взвесить на аналитических весах. Проверить температуру и атмосферное давление. В случае изменения показаний, установленных в начале эксперимента, взять для расчетов средние значения.
Расчетная часть
Давление насыщенного пара вещества вычисляется по уравнению состояния идеального газа, причем предполагается, что смесь пара вещества с воздухом подчиняется закону Дальтона. Число молей сухого воздуха, прошедшего через сосуд вычисляется по формуле
где V − объем вытесненного из газометра воздуха; р − атмосферное давление (показание барометра); Это количество воздуха увлекает за собой По закону Дальтона парциальное давление газа (пара) равно его мольной доле, умноженной на общее давление. Смесь пара с воздухом покидает сосуд (9) при общем давлении
Давление пара необходимо определить при двух температурах и по уравнению (2.13) рассчитать теплоту испарения.
Таблица
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 331; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.116.34 (0.006 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

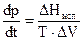 , (2.16)
, (2.16)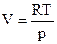 ,
,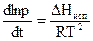 .
.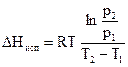 . (2.17)
. (2.17)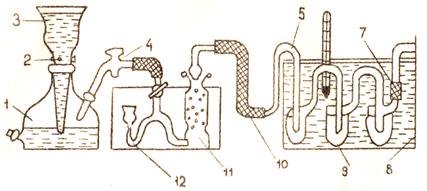
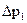 , которое фиксируется с помощью манометра (12).
, которое фиксируется с помощью манометра (12).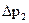 , которые следует вычитать из показаний барометра, приведены в таблице. Здесь же даны значения давления насыщенного пара воды
, которые следует вычитать из показаний барометра, приведены в таблице. Здесь же даны значения давления насыщенного пара воды 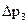 , которые надо вычитать при расчете давления сухого воздуха.
, которые надо вычитать при расчете давления сухого воздуха.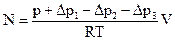 ,
,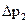 − температурная поправка;
− температурная поправка; 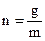 молей пара исследуемого вещества.
молей пара исследуемого вещества.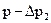 , следовательно
, следовательно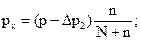
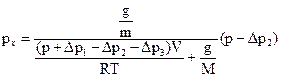 .
.


