
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа № 30. Зависимость скорости реакции от температуры и катализатора
Опыт № 1. Влияние температуры на скорость реакции Цель работы − исследование влияния температуры на скорость химической реакции.
Зависимость скорости реакции от температуры можно наблюдать, пользуясь реакцией взаимодействия тиосульфата натрия с серной кислотой: Na2S2O3 + Н2SО4 → Nа2SO4 + Н2O + SO2 + S↓, в которой образующаяся твердая сера будет вызывать помутнение раствора. Оборудование 1. Три стакана емкостью 300−400 мл. 2. Термометры. 3. Метроном (или секундомер).
Порядок выполнения работы 1. Налить воды в три стакана емкостью каждого 300−400 мл на 3/4 объема. Стаканы накрыть картонными крышками с тремя отверстиями, в одно из которых вставить термометр (два других отверстия предназначены для пробирок). 2. Поставить стаканы на асбестовую сетку. Один из них оставить при комнатной температуре, два других нагреть до определенных температур, различающихся между собой на 10°С, таким образом, чтобы температура воды в стакане № 1 была комнатной, в стакане № 2 − на 10°С выше комнатной, в стакане № 3 − на 10°С выше, чем в стакане № 2. Температуру поддерживать постоянной в течение всего опыта. Они будут выполнять роль термостатов. 3. В одно из свободных отверстий в крышке каждого стакана вставить пробирку с 2 н раствором кислоты и опущенной в нее пипеткой. В другое отверстие поместить пробирку с 10 мл 0,5 н раствора тиосульфата натрия. 4. Не вынимая пробирку с тиосульфатом натрия из стакана № 1, добавить в нее одну каплю 2 н серной кислоты из пробирки, находящейся в том жестакане. По метроному (или по секундомеру) отсчитать время до появления заметной мути. 5. Повторить опыт с растворами тиосульфата и серной кислоты в стаканах № 2 и 3, измеряя время течения реакции, как и в первом случае. 6. Данные наблюдений записать в таблицу:
7. Сделать вывод о зависимости скорости химической реакции от температуры. 8. По полученным данным построить график зависимости скорости реакции от температуры, откладывая по оси абсцисс температуру, а по оси ординат − относительную скорость реакции.
9. Рассчитать температурный коэффициент скорости реакции γ.
Опыт № 2. Влияние катализатора на скорость химической реакции Цель работы − исследование влияния катализаторов на скорость химической реакции на примере каталитического разложения пероксида водорода.
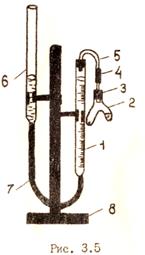
Оценку активности различных катализаторов можно дать на основании наблюдений за объемом выделения кислорода за определенный промежуток времени по реакции: 2H2O2 →2H2O + O2 Скорость разложения пероксида можно изменять, вводя различные катализаторы. Опыт позволяет наглядно оценить активность различных катализаторов путем сравнения объемов кислорода, выделившегося в реакции за один и тот же определенный промежуток времени. Оборудование Схема прибора, используемого в работе, приведена на рис. 3.5. Основными частями прибора являются: рабочая бюретка (1); двухколенная пробирка − пробирка Оствальда (2), соединенная с рабочей бюреткой резиновой пробкой (3), каучуковой (4) и стеклянной (5) трубками; вспомогательная бюретка (6), используемая в качестве уравнительного сосуда. В бюретке находится вода, которую выделяющийся в результате реакции газ вытесняет из рабочей бюретки во вспомогательную. Прибор укрепляется в штативе (8).
Порядок выполнения работы 1. Снять с пробки двухколенную пробирку. 2. Рабочую бюретку укрепить в штативе так, чтобы уровень воды в бюретке совпадал с нулевым делением. Отсчеты уровня жидкости производить по нижнему краю мениска, который должен быть на уровне глаз наблюдателя. 3. В одну часть двухколенной пробирки поместить катализатор (наливать или насыпать его необходимо очень аккуратно, следя за тем, чтобы он не попал в другую часть пробирки). 4. В другую часть пробирки также осторожно налить 2 мл 2,5%-ного раствора пероксида водорода. 5. Двухколенную пробирку плотно надеть на пробку (уровень жидкости в рабочей бюретке при этом незначительно сместится с нулевого деления). 6. Привести давление в пробирке к атмосферному, установив уровни воды в бюретках на одной высоте. 7. Отметить уровень воды в рабочей бюретке до начала разложения перекиси водорода.
8. Проверить прибор на герметичность, так как для успешного выполнения работы необходимо без потерь собрать весь выделившийся кислород. Для этого вспомогательную бюретку либо поднять, либо опустить на 15 − 20 см. Если прибор герметичен, уровень воды в рабочей бюретке сначала снизится, а затем останется без изменения. При возвращении вспомогательной бюретки на прежнее место вода в рабочей бюретке должна быть на том же исходном уровне. 9. Если обнаружится, что прибор не герметичен, необходимо найти причину неполадки и устранить ее, проверив надежность пробок и каучуковой трубки, соединяющей двухколенную пробирку с рабочей бюреткой. 10. После того как установлено, что прибор герметичен, повернуть пробирку таким образом, чтобы привести в контакт перекись водорода с катализатором, отмечая время их соприкосновения. 11. По истечении 2 мин. записать объем выделившегося кислорода, для чего установить мениски воды в обоих бюретках на одном уровне (это условие приведения газа в пробирке к атмосферному давлению). 12. Записать объем выделившегося кислорода. По окончании опыта тщательно вымыть сосуд. 13. Результаты опыта занести в таблицу:
14. Сделать вывод об активности катализаторов в гомогенном и гетерогенном катализе. Описанным способом измерить каталитическое действие следующих катализаторов на разложение пероксида водорода: 1) твердый МпО2 − 0,1 г, 2) активированный уголь − 0,1 г, 3) 40%-ный раствор СuС12 −0,5 мл, 4) 20% -ный раствор FeCl3 − 0,5 мл. Опыт повторить с теми же катализаторами, но с пероксидом водорода, стабилизированным 2%-ной фосфорной кислотой. Заметить, какое влияние оказывает ортофосфорная кислота на разложение пероксида водорода.
Вопросы и задачи к разделу II 1. Что такое скорость химической реакции? 2. От каких факторов зависит скорость химической реакции? 3. Каков физический смысл константы скорости? 4. Что называется порядком реакции и молекулярностью? В каких случаях порядок и молекулярность не совпадают? 5. Зависимость скорости реакции от концентрации; закон действия масс для гомогенных и гетерогенных процессов. 6. Влияние температуры на скорость реакции. Правило Вант-Гоффа. 7. Что называется энергией активации? Напишите уравнение Аррениуса. 8. Какие вещества называются катализаторами? Механизм действия катализаторов. 9. Какие реакции называются цепными? Каков их механизм? 10. При 150 оС некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент реакции равным 2,5, рассчитайте, через сколько минут закончилась бы эта реакция при 200 оС ; при 80 оС . 11. Во сколько раз следует увеличить концентрацию водорода, чтобы скорость реакции N2 + 3H2 = 2NH3 возросла в 1000 раз? Как нужно изменить давление, чтобы добиться такого же ускорения реакции?
Раздел III. ФИЗИКО−ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ ВЕЩЕСТВ
ГЛАВА 4. ФИЗИКО−ХИМИЧЕСКИЙ АНАЛИЗ
Работа № 31. ИЗУЧЕНИЕ ДИАГРАММЫ ПЛАВКОСТИ СИСТЕМЫ ФЕНОЛ−НАФТАЛИН
Цель работы − ознакомление с методом термического анализа и построение диаграммы плавкости двухкомпонентной системы.
Диаграмма плавкости двухкомпонентной системы представляет собой кривую, построенную в координатах «температура плавления (кристаллизации) – состав смеси». Для построения диаграммы, таким образом, нужно измерить температуру плавления (кристаллизации) чистых веществ − нафталина и фенола и сплавов различного состава.
Оборудование и реактивы
1. 10 пробирок с пробками, имеющими отверстия для термометров. 2. Термометры. 3. Смеси фенола и нафталина в различном соотношении (см. таблицу). Порядок выполнения работы 1. Получить у лаборанта пробирки со смесями фенола и нафталина известного состава. 2. Вставить в пробирки термометры таким образом, чтобы ртутные шарики термометров вставленных в пробки пробирок были погружены в сплав. 3. Одну из пробирок со смесью поместить в стакан с холодной водой и нагреть на пламени горелки. Когда начнется плавление, уменьшить пламя горелки. 4. Наблюдать за показаниями термометра и записать температуру, при которой расплавятся последние кристаллы (температура плавления). 5. Вынуть пробирку из стакана и, охлаждая ее на воздухе, наблюдать за появлением первых кристаллов. 6. Записать температуру, при которой они появились (температура кристаллизации). 7. Повторить аналогичные опыты с остальными пробирками, состав которых указан в таблице. 8. Результаты опытов записать в таблицу:
9. По данным опыта построить диаграмму плавкости системы, определить процентный состав эвтектической смеси и ее температуру плавления.
Контрольные вопросы 1. В чем сущность физико-химического анализа? 2. Какую зависимость выражает диаграмма плавкости? 3. Что называется эвтектикой? 4. Что называется числом степеней свободы? 5. Сформулируйте правило фаз.
Глава 5. ФИЗИКО−ХИМИЧЕСКИЕ СВОЙСТВА ПОЛИМЕРОВ
Общие сведения о полимерах
Полимеры – это высокомолекулярные соединения, макромолекулы которых состоят из повторяющихся структурных звеньев, соединенных между собой химическими связями.
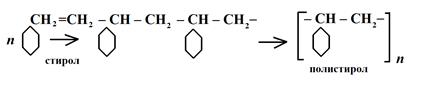
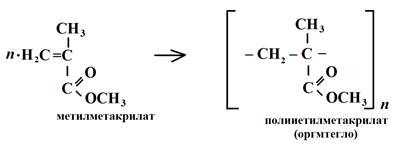
Молекулы полимеров отличаются от молекул низкомолекулярных соединений тремя основными признаками: большой молекулярной массой (до 106 у.е.), цепным строением и гибкостью молекул. Существует два способа получения полимеров: реакции полимеризации и реакции поликонденсации. В первом случае химический состав звена полученного соединения полностью соответствует химическому составу мономера, так как образование цепочки полимера осуществляется за счет разрыва двойных и тройных связей в молекулах мономеров. Так получают: полиэтилен, полистирол, полиизопрен, полиметилметакрилат и др. n (CH2 = CH2) → CH2 – CH2 – CH2 – CH2 - … CH2 – CH2 → [- CH2 – CH2 -]n
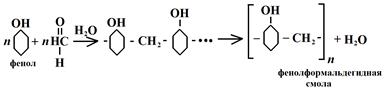
Реакции, в которых кроме полимера происходит образование побочного низкомолекулярного продукта за счет взаимодействия функциональных групп мономеров, например Н2О, NH3, HCl, называются реакциями поликонденсации. В этом случае химический состав макромолекул полимера отличается от исходного мономера на величину выделившихся продуктов. Например, при реакциях образования полигексаметилендиамида (найлона) (1) и полиформальдегида (2) выделяется вода
Размер молекул полимера и его молекулярная масса определяются числом структурных звеньев, входящих в макромолекулу полимера, и называются степенью полимеризации n: n = Физико-химические и механические свойства полимеров (прочность на разрыв, эластичность, температурный предел ее проявления, текучесть) находятся в прямой зависимости от величины степени полимеризации n, состава и структуры полимера. Полимеры имеют довольно сложное пространственное строение. Цепь углеродных атомов, даже в простейшем случае полиэтилена, представляет собой пространственную спираль (рис. 5.1) с шагом 2,5 Ао и меняющимся направлением оси: постоянными величинами будут углы между связями «с – с» При этом ориентация звеньев [-СН2–СН2 - ] строго определенна. Энергетически выгодны только несколько положений. При наличии замещающих групп в цепи углеродных атомов появляется дополнительное усложнение цепи, зависящее от ориентации этих групп.
Рис. 5.1
Рис. 5.2 На рис. 5.2 показано различное пространственное расположение заместителей водорода и приведены типы структуры линейных полимеров: а) атактический – беспорядочное расположение радикалов; б) изотактический – радикалы расположены с одной стороны относительно цепи; в) синдиотактический или стереорегулярный – строго повторяющийся порядок расположения радикалов относительно цепи. Наиболее устойчивыми свойствами обладают полимеры с синдиотактическим или стереорегулярным строением цепи (в). При наличии двух замещенных атомов водорода строение цепи усложняется еще больше. Формы и пространственное расположение цепей (укладка) при образовании макромолекул также весьма сложны и многообразны. Возможность изменения способа укладки (распрямление цепи) и определяет эластические и пластические свойства полимеров.
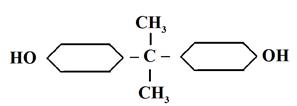
Эпоксидные олигомеры – полимеры с небольшой степенью полимеризации n (10 –100) используются в качестве полимерных связующих при получении конструкционных и электроизоляционных стеклопластиков. Конструкционные элементы из стеклопластиков применяются для изготовления силового набора и обшивок крыльев, фюзеляжа, носовых и хвостовых конусов летательных аппаратов, а также для конусов, сопл, лопаток и статоров, компрессоров некоторых реактивных двигателей. Эпоксидные олигомеры используются в качестве заливочных компаундов (смесей полимера с низкомолекулярным веществом) в электро- и радиооборудовании. Клеи на основе эпоксидных олигомеров отличаются высокими адгезионными свойствами (адгезия – сцепление). К эпоксидным олигомерам относятся синтетические вещества, в молекулы которых входят эпоксидные группы Эпоксидные олигомеры получаются в результате реакции поликонденсации за счет взаимодействия функциональных групп мономеров. Наиболее широкое промышленное применение получили эпоксиднодиановые олигомеры, представляющие собой продукты реакции поликонденсации 2,2-парагидроксидифенилолпропана с эпихлоргидрином
Процесс образования эпоксидных олигомеров идет в несколько стадий, и в результате получаются молекулы, структура которых может быть представлена схемой
В приведенной формуле R соответствует группа
. В зависимости от соотношения компонентов и количества щелочи получаются олигомеры с различной молекулярной массой приблизительно от 300 до 3000 у.е. К низкомолекулярным относятся эпоксидные олигомеры с молекулярной массой до 1500 у.е., имеющие степень полимеризации n от 1 до 3. Они представляют собой жидкие или сиропообразные вещества, хорошо растворимые в ароматических и алифатических углеводородах и не растворимые в спиртах. При n, равном 4−10, получают соединения с молекулярной массой более 1500 у.е. Это твердые вещества, растворимые в спиртах, а также в алифатических и ароматических углеводородах. Количественной характеристикой величины молекулярной массы эпоксидных олигомеров служит эпоксидное число, выражающее процентное содержание эпоксидных групп в молекуле данного олигомера. Для определения эпоксидного числа используют реакцию взаимодействия эпоксидных групп с соляной кислотой, добавленной в виде раствора в ацетоне. Реакция протекает по схеме
Избыток HCl,не вошедший в реакцию, титруется раствором едкого натра в присутствии индикатора. По количеству связанного с олигомером хлористого водорода рассчитывается процентное содержание эпоксидных групп в олигомере, а затем его молекулярная масса и степень полимеризации.
Вискозиметрия Вязкость является одной из важнейших характеристик жидких и полужидких материалов, например, масел, лаков, заливочных и пропиточных компаундов, различных клеевых композиций, лакокрасочных материалов и т.д. По вязкости можно косвенно судить о строении и некоторых свойствах высокомолекулярных соединений. Под вязкостью жидкости понимают сопротивление перемещению одного ее слоя относительно другого. Поэтому вязкость часто называют внутренним трением. Различают вязкость динамическую, кинематическую (абсолютную) и условную. Динамической вязкостью или коэффициентом внутреннего трения называется сила, которая должна быть приложена для того, чтобы в слое жидкости толщиной 1 см и площадью 1 см2 верхняя поверхность слоя перемещалась относительно нижней ее поверхности со скоростью 1 см/с. Если при этом сила равна 1 дн, то вязкость жидкости 1 пз (пуаз), где 1 пз = 100 спз = 1 Г/см∙с. Вязкость воды при t = 20 оС равна 0,01 пз. Кинематическая, или абсолютная, вязкость есть отношение динамической вязкости жидкости к ее плотности. Единицей кинематической вязкости является стокс (ст). С повышением температуры вязкость многих жидкостей уменьшается вследствие ослабления сил сцепления между молекулами, что обусловлено расширением жидкости и увеличением интенсивности теплового движения молекул. Кинематическая вязкость ηк = с∙τ1, где с – постоянная вискозиметра, указаннная в его паспорте, определяется при 200С с помощью специальных калибровочных жидкостей с известной вязкостью; τ1 – среднее время истечения калибровочной жидкости, например воды. Вязкость растворов полимеров сильно зависит от величины молекулярной массы полимера, а также от формы его макромолекул. Взаимосвязь вязкости раствора полимера с его молекулярной массой можно выразить формулой
где М – молекулярная масса полимера; кτ – константа, характерная для раствора данного полимера в определенном растворителе; . Вискозиметрический метод часто используют для определения молекулярных масс полимеров. Наиболее точные данные получаются для линейных полимеров, имеющих высокие значения молекулярных масс от 5000 до 50000 у.е.
Контрольные вопросы 1. Приведите примеры полимеров с линейной структурой молекулы. 2. Приведите примеры уравнений реакций получения полимеров. 3. Как зависят свойства полимеров от структуры их молекул? 4. Дайте определение реакции полимеризации и поликонденсации. Приведите примеры этих реакций. 5. Что такое степень полимеризации? Как можно рассчитать эту величину? 6. Приведите примеры применения полимеров в технике и в быту. 7. Напишите схему получения эпоксидной группы. 8. Строение и масса эпоксидной группы. 9. Назовите примеры применения эпоксидных полимеров. 10. Что такое эпоксидное число и как его определяют? 11. Что называется вязкостью: динамической, относительной? 12. Как определить относительную вязкость? 13. Напишите формулу определения молекулярной массы полимера. 14. Существует ли зависимость между величиной молекулярной массы полимера и вязкостью его раствора? 15. Как определить относительную вязкость раствора полимера? 16. На чем основан вискозиметрический метод определения молекулярной массы полимера?
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 390; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.79.60 (0.09 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 этилен полиэтилен
этилен полиэтилен


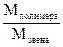
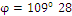 и расстояния между атомами «с – с » 1,54 Ао.
и расстояния между атомами «с – с » 1,54 Ао. 

 .
.
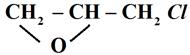 .
. .
.
 .
.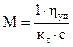 ,
, 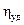 − величина, обратная относительной вязкости, которая равна отношению времени истечения раствора полимера
− величина, обратная относительной вязкости, которая равна отношению времени истечения раствора полимера 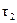 ко времени истечения чистого растворителя
ко времени истечения чистого растворителя 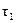 .
.


