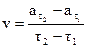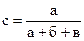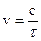Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа № 28. Фотохимическое разложение перекиси водорода
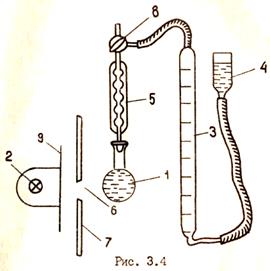
Цель работы − изучение кинетики цепной фотохимической реакции разложения Н2О2с применением газометрического метода и определение константы нарастания скорости реакции. Оборудование Схема установки представлена на рис. 3.4.
Порядок выполнения работы
1. Налить в кварцевую колбу (1) определенное (по указанию преподавателя) количество дистиллированной воды и перекиси водорода. Соединить колбу с обратным холодильником (5), установив ее против отверстия (6) в защитном щите (7). 2. Пустить воду в холодильник. 3. Открыть кран (8) и с помощью уравнительного сосуда (4) установить уровень жидкости в бюретке (3) на нулевом делении. Повернуть кран (6) таким образом, чтобы бюретка была соединена с холодильником. Проверить герметичность прибора. 4. После включения лаборантом ртутно-кварцевой лампы (2) через 1-2 мин. открыть заслонку (9) и одновременно включить секундомер. 5. Отметить время, за которое выделится 1мл кислорода. Последующие измерения делать через каждые 2 мин. Когда скорость выделения кислорода достигнет 2 мл в 2 мин., делать замеры ежеминутно. Опыт прекратить, когда выделится 75−80 мл кислорода. 6. Записать результаты измерений в таблицу:
7. Вычислить скорость реакции в различные моменты времени c интервалом 2 мин. по формуле: 8. Построить график зависимости v = f(τ),откладывая время в минутах по оси абсцисс. По восходящей ветви построенной кривой взять значение vв различные моменты времени и построить график зависимости lnv = f(τ) 9. Определить константы Аиφпо уравнению (3.14), которое после логарифмирования принимает вид lnv = lnA + φτ. Это уравнение является уравнением прямой в системе координат lnV−τ Отрезок, отсекаемый прямой на оси ординат при значении τ = 0, дает величину ln A, а тангенс угла наклона прямой к оси τ определяет величину φ. Работа № 29. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ РЕАГИРУЮЩИХ ВЕЩЕСТВ Цель работы − исследование влияния изменения концентрации веществ на скорость химических реакций.
Зависимость скорости реакции от концентрации можно изучить, пользуясь реакцией взаимодействия серноватисто-кислого (тиосульфата) натрия с серной кислотой: Nа2 S2O3 + Н2 SO4 → Nа2 SO4 + H2O + SO2 + S↓. Выделившаяся из раствора сера делает раствор мутным. По промежутку времени от начала реакции до заметного помутнения раствора можно судить об относительной скорости этой реакции.
Оборудование 1. Бюретки. 2. Химические стаканы. 3. Метроном. Порядок выполнения работы 1. Заполнить выше нулевого деления три бюретки, закрепленные в штативе: первую – 2 нраствором тиосульфата, вторую − дистиллированной водой, третью − раствором серной кислоты (см. правила пользования бюреткой). 2. В семи стаканах приготовить растворы Nа2S2O3 в воде в соотношениях, указанных в таблице:
3. Налить в стакан № 1 из бюретки 1,5 мл 1 н раствора серной кислоты, перемешать раствор и сразу же включить метроном (момент сливания должен совпадать с моментом удара метронома, который принять за ноль отсчета). При появлении едва заметной мути опыт прекратить. Результаты (число ударов метронома) записать. 4. Повторить опыт со смесями в стаканах № 2−7. 5. По окончании каждого опыта тщательно вымыть стаканы. 6. Результаты свести в таблицу. 7. На миллиметровой бумаге начертить график зависимости v (ось ординат) от C (ось абсцисс). 8. Сделать вывод о зависимости скорости реакции vот концентрацииреагирующих веществ. Как согласуются ваши наблюдения с законом действующих масс?
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 488; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.173.112 (0.007 с.) |