
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Построение калибровочного графикаСодержание книги
Поиск на нашем сайте
1. Налить в одну бюретку исходный раствор J2в КJс концентрацией 0,01 моль/л, в другую − дистиллированную воду. 2. Из исходного раствора в четырех стаканчиках приготовить серию стандартных окрашенных растворов с различной концентрацией йода путем точного разбавления исходного раствора дистиллированной водой (см. таблицу).
3. Залить в одну из кювет дистиллированную воду и установить кювету в правое гнездо кюветодержателя. В другую кювету залить один из испытуемых растворов и вставить ее в левое гнездо кюветодержателя (кювету предварительно необходимо сполоснуть этим же раствором). Раствор должен быть залит почти до краев кювет. Держать кюветы можно только за матовые грани. Наружные стенки кювет должны быть сухими. Для этого после заливки раствора их нужно промокнуть фильтровальной бумагой. Вставлять кюветы следует так, чтобы световой поток проходил через прозрачные грани. При измерении оптической плотности крышка прибора должна быть закрыта. 4. Поочередно нажать и отпустить кнопки «Сброс» (любую из двух) и «Измерение», снять три-четыре показания с цифрового табло и взять среднее значение. Примечание: 1. Кнопку «ИЗМЕРЕНИЕ» нажимать не чаще 1 раза в 15 сек. 2. При эксплуатации прибора во избежание выхода из строя транзисторов категорически запрещается нажимать кнопку «ИЗМЕРЕНИЕ» без вставленного в гнездо светофильтра. 3. Следить за чистотой кювет. 5. Построить калибровочный график в координатах «оптическая плотность раствора (ось абсцисс) − концентрация (ось ординат)», т.е. зависимость D = f(С). В дальнейшем с помощью этой калибровочной прямой, проходящей через начало координат, по измеренной оптической плотности исследуемого раствора D определяется его концентрация С. Проведение самого анализа 6. В чистую кювету налить раствор смеси (0,05М KJOзи 0,125M КJ) и вставить кювету в правый кюветодержатель фотоколориметра как раствор сравнения. 7. Приготовить основной раствор уксусного ангидрида, который используется для кинетического исследования. Для этого: 7.1. В стакан на 50 мл налить немного более половины его
7.2. С помощью лаборанта прилить необходимое количество уксусного ангидрида в стакан. В момент приливания заметить время (с точностью до секунды). Раствор перемешать и долить до метки 50 мл раствором KJО3 + KJ. Засечь время конца растворения. 8. Полученной реакционной смесью заполнить кювету, вставить ее в левый кюветодержатель фотоколориметра. 9. Замечая время, сделать замеры оптической плотности раствора через следующие промежутки времени: два измерения через 1 мин., два измерения через 2 мин., два измерения через 5 мин., четыре измерения через 10 мин. Среднее время от начала растворения уксусного ангидрида до его конца принимается за начало реакции. 10. Результаты занести в таблицу, записав следующие условия эксперимента:Температура опыта (Т). . Концентрация уксусного ангидрида (C0)…0,018 м/л Время начала растворения.................................................................................. Время конца растворения..................................................................................... Время начала реакции..........................................................................................
11. Построить график зависимости tg(C0-Cx) = f(τ). 12.Рассчитать константу скорости для каждого момента от начала реакции. Так как реакция гидратации уксусного ангидрида псевдомономолекулярна, расчет вести по кинетическому уравнению первого порядка:
13. Вычислить среднее значение kи сравнить с полученной по графику (С0-Cx) = f(τ), как tgугла наклона прямой к оси τ. 14. По константам скорости, определенным для двух температур, рассчитать величину энергии активации данной реакции
15. По окончании работы выключить прибор, вымыть кюветы и сдать их лаборанту вместе со светофильтром.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 185; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.219.123 (0.009 с.) |

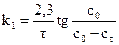
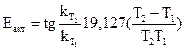 ;
; 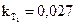 (T1 = 272 K)
(T1 = 272 K)


