
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа № 23. Определение теплоты растворения
ТРУДНОРАСТВОРИМЫХ СОЕДИНЕНИЙ МЕТОДОМ ИЗМЕРЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ Цель работы − определение теплоты растворения труднорастворимой соли.
Ддя расчета теплоты растворения труднорастворимых соединений может быть использовано уравнение Вант−Гоффа (2.7). Если значения констант равновесия выразить через произведения растворимости (ПР) при двух температурах, получим Для расчета ПР необходимо знать концентрацию ионов над осадком или растворимость осадка. Для равновесия в растворе соли, распадающейся на два иона:
Растворимость и ПР = S2. Для определения растворимости можно использовать метод измерения электропроводности, учитывая, что растворимость (концентрация насыщенного раствора) связана с удельной и эквивалентной электропроводностью соотношением
где S− растворимость данного вещества; æ − удельная электропроводность его насыщенного раствора; λ − эквивалентная электропроводность этого раствора. Обычно для труднорастворимых электролитов насыщенный раствор бывает настолько разбавленным, что λ при данной концентрации мало отличается от электропроводности при бесконечном разбавлении λ∞. Величину λ∞ можно вычислить из подвижностей отдельных ионов электролита:
Таким образом, зная величину λ∞ и определяя из опыта χ, можно рассчитать растворимость по уравнению
При этом следует иметь в виду, что электропроводность таких разбавленных растворов невелика и соизмерима с электропроводностью воды. Поэтому величина χ вычисляется из разности где Для пересчета справочных данных по подвижностям ионов, которые приведены для T = 298 К, на величины, соответствующие температуре опыта, используют уравнение где α− температурный коэффициент электропроводности, составляющий для солей величину 0,02-0,025. Определивпри двух температурах растворимость Sи рассчитав
Оборудование 1. Коническая колба для растворения соли. 2. Воронка, бумажные фильтры. 3. Сосуд для измерения электропроводности. 4. Реохордный мост или кондуктометр. 5. Термостат. Порядок выполнения работы
1. Небольшое количество труднорастворимой соли тщательно растереть в ступке и перенести в коническую колбу с притертой пробкой, промыть соль два-три раза дистиллированной водой для удаления легкорастворимых примесей. 2. Отмытую соль залить 100 мл дистиллированной воды и, плотно закрыв пробкой, непрерывно перемешивать в течение 20 мин. Полученной суспензии дать отстояться. 3. После отстаивания осадка часть раствора слить в сосуд для измерения электропроводности и измерить сопротивление раствора 4. Оставшийся раствор с осадком поместить в термостат и выдержать в нем не менее 20 мин, при температуре Т2 = 40°С. 5. Часть горячего раствора слить в сосуд для измерения электропроводности и измерить сопротивление раствора 6. Рассчитать растворимость соли Sпри температурах Т1и Т2, полагая, что æ р-ра = 7. Определить величины произведения растворимости 8. Рассчитать
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 280; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.154.151 (0.006 с.) |
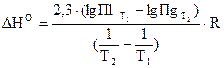 . (2.18)
. (2.18)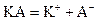 .
.
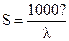 ,
, .
.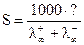 .
. ,
, − удельная электропроводность исследуемого раствора;
− удельная электропроводность исследуемого раствора; 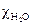 − удельная электропроводность воды, равная 1·10-6 Ом-1 см-1.
− удельная электропроводность воды, равная 1·10-6 Ом-1 см-1. ,
,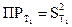 и
и 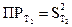 , по уравнению (2.14) можно найти теплоту растворения
, по уравнению (2.14) можно найти теплоту растворения 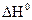 .
.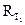 при комнатной температуре.
при комнатной температуре.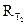 .
.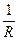 .
.


