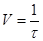Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 4. Зависимость скорости реакции от температурыСодержание книги
Поиск на нашем сайте
Реактивы: 2н. раствор серной кислоты; 1н. раствор тиосульфата натрия; дистиллированная вода. Посуда и принадлежности: микропробирки; пипетки; секундомер; водяная баня (стакан с горячей водой); термометр. Методика проведения опыта. Зависимость скорости реакции от температуры можно рассмотреть на примере реакции, описанной в опыте 3. При комнатной температуре приготовьте раствор из 4 капель 1н. раствора тиосульфата натрия и 8 капель воды, внесите в него 1 каплю 2н. раствора серной кислоты. Отметьте время появления мути в пробирке. Повторите опыт для температур на 10, 20 и 30 оС выше комнатной, предварительно поместив пробирки на 5 мин в стакан с водой соответ-ствующей температуры. Результаты наблюдений запишите в таблицу 1.6. По данным таблицы 1.6 постройте график зависимости относительной скорости реакции от температуры. Рассчитайте значение температурного коэффициента, исходя из полученных данных. Укажите, каков физический смысл этого коэффициента. Сделайте вывод о зависимости скорости реакции от температуры и объясните причину этой зависимости. Таблица 1.6 – Зависимость скорости реакции от температуры
Опыт 5. Зависимость скорости реакции от катализатора В основе опыта лежит реакция разложения пероксида водорода: 2H2O2 = 2H2O + О2↑ Опыт 5.1. Гомогенный катализ Реактивы и материалы: 3-процентный раствор пероксида водорода; 2н. раствор серной кислоты. Посуда: пробирки. Методика проведения опыта. В две пробирки налейте по 1-2 мл раствора пероксида водорода. В одну внесите 0,5-1 мл раствора серной кислоты. Отметьте, изменяется ли скорость газообразования при добавлении кислоты. В выводах отметьте, к какому типу относится использованный катализатор: является положительным или отрицательным, гомогенным или гетерогенным. Гетерогенный катализ Реактивы: 3-процентный раствор пероксида водорода; порошок оксида марганца (IV). Посуда и принадлежности: пробирки; микрошпатель. Методика проведения опыта. В две пробирки налейте по 1-2 мл раствор пероксида водорода. В одну внесите на кончике шпателя немного порошка оксида марганца (IV). Наблюдайте за разложением пероксида водорода в обеих пробирках. В выводах отразите, как влияет данный катализатор на скорость химической реакции, к какому типу Вы его отнесете и почему. Опыт 6. К олебательная реакция с выделением газообразного азота (УИРС) Колебательными называют реакции, в ходе которых концентрации промежуточных соединений и скорость реакции испытывают колебания. Колебания могут быть периодическими, непериодическими или иметь непрерывный спектр. Колебательные реакции протекают, например, при окислении СО, Н2, NH3, C2H4, CH3OH, а также лежат в основе важнейших биологических процессов (мышечного сокращения, генерации биоритмов). В основе процесса, изучаемого в опыте, лежит окислительно-восстановительная реакция разложения водного раствора нитрита аммония (реакция диспропорционирования): -3 +3 0 NH4 NO2 → N2 + 2H2O В ходе этой реакции последовательно протекают следующие процессы: образование центров газовыделения (пересыщенного раствора азота); рост пузырьков газа (насыщенного раствора из-за уменьшения концентрации растворенного газа); выделение газа (в результате умень-шения концентрации растворенного азота ниже предела насыщаемости); остановка процесса возникновения центров газовыделения. Поскольку разложение водного раствора нитрита аммония продолжается, раствор снова становится пересыщенным, и в конечном счете формирование пузырьков ведет к новому выделению газообразного азота. Таким образом, колебания реакции связаны с ростом пузырьков азота, обусловленного периодическим выделением азота за пределы сферы реакции. Реактивы и материалы: сульфат аммония; нитрит натрия; раствор серной кислоты (0,2 М). Приготовление растворов реагентов: Раствор серной кислоты(СМ = 0,2 М). При охлаждении и перемешивании осторожно растворяют 11 мл концентрированной серной кислоты в 500 мл дистиллированной воды в мерной колбе на 1 л и после охлаждения доводят объем раствора до 1 л дистиллированной водой. Раствор А.Растворяют 26 г сульфата аммония в 100 мл 0,2 М раствора серной кислоты в конической колбе. Раствор В. Растворяют 28 г нитрита натрия в 100 мл дистиллированной воды в конической колбе.
Посуда, принадлежности и оборудование: стеклянный стакан (примерно на 2 л); стеклянная палочка; мерный цилиндр или стакан на 1 л; мерный цилиндр на 100 мл; две конические колбы (250 мл); магнитная мешалка. Методика проведения опыта. В стеклянный цилиндр налейте по 10 мл растворов А и В и быстро их перемешайте. Дальнейшее наблюдение за ходом реакции ведите при медленном перемешивании на магнитной мешалке. Отметьте начало выделения газа, затем оно прекращается. Отметьте начало нового газообразования (примерно через 8 с). Через минуту процесс выделения газа становится более энергичным и четким. Наблюдаемая колебательная реакция продолжается около 4 мин. В выводах отразите, почему проведенная реакция является колебательной и укажите характерные особенности таких реакций. Напишите выражение скорости проведенной реакции по закону действия масс.
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 351; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.9.9 (0.006 с.) |