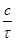Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 2. Зависимость скорости реакции от природы реагирующих веществСодержание книги
Поиск на нашем сайте
В основе опыта лежит взаимодействие мела с соляной и уксусной кислотами: CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ CaCO3 + 2СН3СООН = (СН3СОО)2 Ca + H2O + CO2↑ Реактивы и материалы: порошок мела; фильтровальная бумага; 1 М раствор соляной кислоты; 1 М раствор уксусной кислоты. Посуда и принадлежности: пробирки; микрошпатель. Методика проведения опыта. Шпателем насыпьте в две пробирки одинаковое количество порошка мела. В одну пробирку налейте 1-2 мл раствора соляной кислоты, в другую – такой же объем раствора уксусной кислоты. Сравните результаты наблюдений в обеих пробирках. В выводе объясните причины различия скоростей обеих реакций. Напишите выражения скоростей проведенных реакций, используя закон действующих масс.
Опыт 3. Зависимость скорости реакции от концентрации реагирующих веществ при постоянной температуре (полумикро-метод) В основе опыта лежит реакция, протекающая по уравнению: Na2S2O3 + H2SO4 = Na2SO4 + H2O + SO2 + S↓ Образующаяся в реакции сера выделяется в виде мутного осадка. Время от начала реакции до появления первых следов помутнения при постоянной температуре зависит от концентрации реагирующих веществ. Реактивы: 2н. раствор серной кислоты; 1н. раствор тиосульфата натрия; дистиллированная вода. Посуда и принадлежности: микропробирки; пипетки; секундомер. Методика проведения опыта. Для проведения опыта в четырех пробирках приготовьте равные объемы растворов тиосульфата натрия (Na2S2O3) различной концентрации. Для этого в каждую пробирку внесите пипеткой по каплям раствор тиосульфата натрия и воду в количествах, указанных в таблице 1.5. Приняв относительную концентрацию раствора в первой пробирке (4 капли Na2S2O3 + 8 капель H2O) за единицу, заполните колонку 6 таблицы 1.5 соответствующими значениями относительной концентрации Na2S2O3 для остальных пробирок. В пробирку № 1 внесите каплю раствора серной кислоты, одновременно включите секундомер и отметьте время, прошедшее от сливания растворов до появления помутнения. Аналогично поступайте и с другими пробирками, стараясь каждый раз зафиксировать время достижения одинаковой степени помутнения. Рассчитайте относительную практическую скорость реакции для каждого случая, зная исходную относительную концентрацию раствора тиосульфата натрия в каждом случае.
Таблица 1.5 – Зависимость скорости реакции от концентрации веществ
Зависимость между концентрацией раствора тиосульфата натрия и скоростью реакции изобразите графически, откладывая на оси абсцисс концентрацию раствора, а на оси ординат – скорость реакции. Какой линией выражается найденная зависимость? Напишите выражение скорости проведенной реакции по расходу реагентов и ее скорости по накоплению продуктов, используя закон действующих масс. Сделайте вывод о зависимости скорости реакции от концентрации тиосульфата натрия и объясните, почему эта зависимость существует.
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 381; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.127.152 (0.008 с.) |