
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакция иммунной флуоресценции (РИФ)Содержание книги
Поиск на нашем сайте
Цель занятия: ознакомиться с принципом серологических реакций; изучить реакцию иммунной флуоресценции; овладеть методом люминесцентной микроскопии Серологические реакции широко используют в вирусологии. В их основе лежит способность специфических антител взаимодействовать с гомологичными антигенами вирусов вне организма (in vitro) с образованием комплекса антиген – антитело. Антигены это вещества, которые несут признаки генетически чужеродной информации и при введении в организм вызывают развитие специфических иммунологических реакций. Антитела это специфические белки (иммуноглобулины), которые синтезируются в организме против различных антигенов в результате естественной инфекции или искусственной иммунизации и находятся в составе сыворотки крови, лимфы, молозива, слизистого покрытия эпителия и других биологических жидкостей. Свойство антител вступать в специфическую связь с гомологичным антигеном обусловлено комплементарным физико-химическим взаимодействием их активных центров с детерминантами антигена. В серологических реакциях выделяют две фазы: специфическую (невидимую), характеризующуюся взаимодействием антител с антигенами, и не специфическую (видимую), которая завершается каким-либо феноменом, позволяющим провести учёт результата реакции. Например, в реакции диффузионной преципитации это образование преципитата (осадка) в агаровом геле; в реакции непрямой гемагглютинации – агглютинация эритроцитов, в реакции торможения гемадсорбции – адсорбция эритроцитов на клетках, зараженных вирусом; в реакции иммуноферментного анализа – окрашивание; в реакции иммунной флуоресценции – свечение; в реакции нейтрализации – отрицательная биопроба и т.д. Серологические реакции используют для решения практических и научных вопросов в ветеринарии, медицине и других областях. В нашей стране и за рубежом созданы целые биотехнологические индустрии, занимающиеся производством наборов реагентов для разнообразных серологических реакций. Реакция иммунной флуоресценции (РИФ) или метод флуоресцирующих антител (МФА). Принцип метода заключается в том, что антитела, связанные с флуорохромом, сохраняют способность вступать в специфическую связь с гомологичным антигеном. Образующийся комплекс обнаруживают по характерному свечению в люминесцентном микроскопе.
В РИФ также можно выделить две фазы: специфическую невидимую с образованием комплекса антиген – антитело и неспецифическую видимую, которая завершается флуоресценцией. Для получения антител используют высокоактивную гипериммунную противовирусную сыворотку крови, а также антивидовую сыворотку, из которых выделяют глобулиновую фракцию соответствующих антител и соединяют (конъюгируют) с флуоресцирующей меткой. Такие антитела называются конъюгаты. Их производством занимаются на предприятиях биологической промышленности. Флуоресценция это разновидность люминесценции, которая заключается в кратковременном свечении в момент поглощения энергии и прекращающееся сразу после его окончания. Вещества, обладающие интенсивной флуоресценцией, используются в качестве так называемой флуоресцирующей метки и называются флуорохромы. Люминесцентное свечение подчиняется правилу Стокса – Ломмеля, согласно которому длина волны люминесценции больше, длины волны возбуждающего света. Т.е. энергия фотонов люминесценции меньше энергии фотонов возбуждающего света. Так, если в качестве возбуждающего света используют ультрафиолетовую или сине-фиолетовую часть спектра (самая короткая длина световой волны), то свет флуоресценции, может соответствовать, например, жёлто – зелёным или красно – оранжевой части спектра. Люминесцентную микроскопию проводят в люминесцентном (флуоресцентном) микроскопе (рис. 23) который устанавливают в затемнённом хорошо вентилируемом помещении В таком приборе используют светофильтры для выделения возбуждающей сине – фиолетовой части спектра,
В вирусологической практике люминесцентную микроскопию используют в методе флуорохромирования и РИФ (МФА). Флуорохромирование - это нанесение на препарат флуорохромной метки с последующей люминесцентной микроскопией. Наиболее широко применяют акридиновую группу флуорохромов (акридиновый оранжевый, акридиновый жёлтый и др.) и тиозиловую группу (примулин, флуоресцина изотиоционат – ФИТЦ, родамин сульфохром - РСХ). Данный метод использовался при изучении таких вирусов, как вирус оспы, вирус болезни Борна, аденовирусы и др.
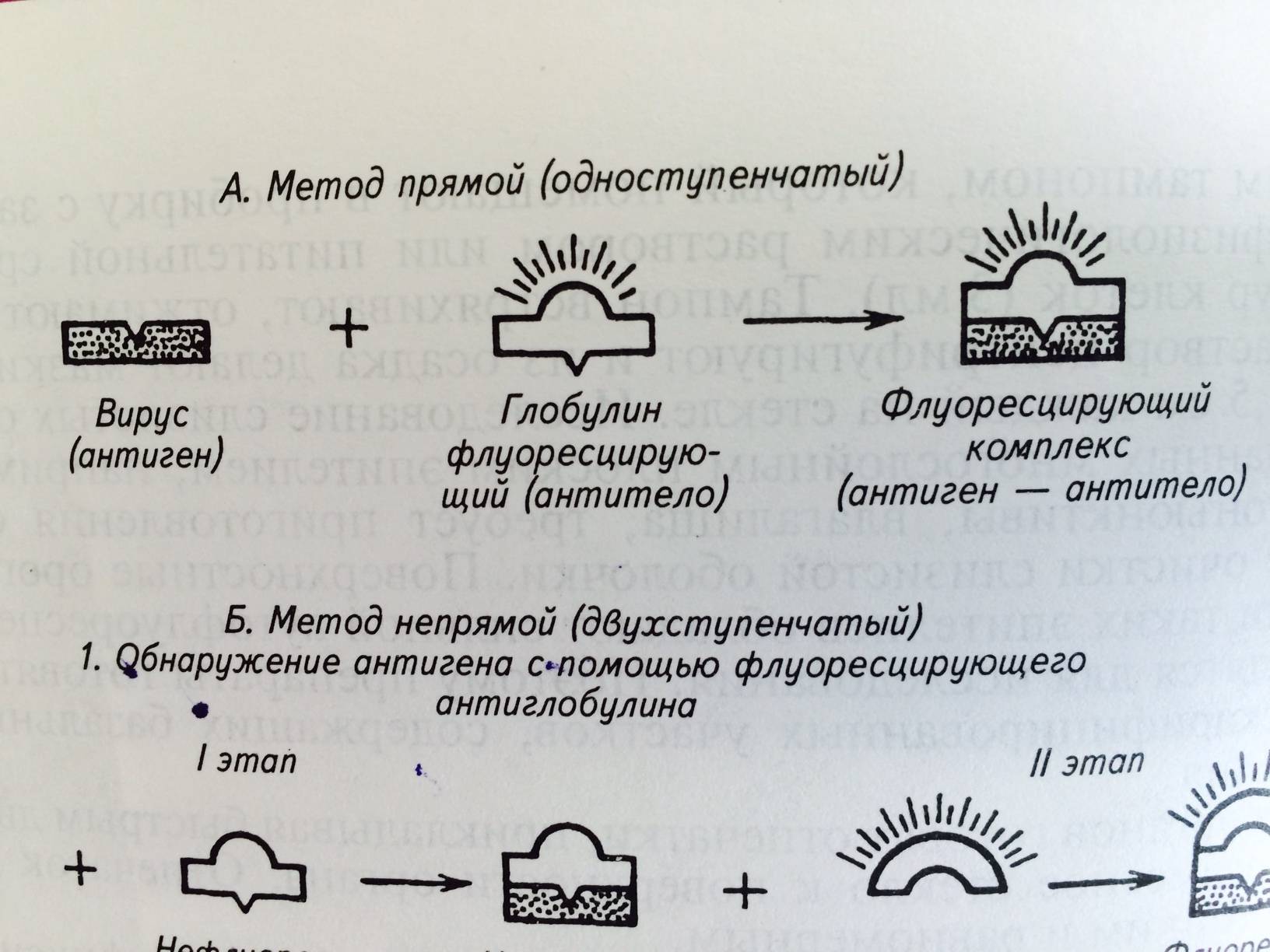
Наибольший интерес представляет акридиновый оранжевый, который вызывает полихромную флуоресценцию разных типов нуклеиновых кислот. Так, при обработке препарата этим флуорохромом ДНК ярко флуоресцирует зелёным цветом, РНК – красным или оранжевым. Методика флуорохромирования: Способ 1 1 На предметном стекле готовят мазок-отпечаток (из патологического материала или суспензии клеток, заражённых вирусом). 2 Наносят 1–2 капли рабочего водного раствора (в разведении 1:10000) акридинового оранжевого и накрывают покровным стеклом. 3 Проводят люминесцентную микроскопию через 10–20 минут после приготовления препарата. Способ 2 1 На предметном стекле готовят мазок-отпечаток (из патологического материала или суспензии клеток, заражённых вирусом). 2 Фиксируют 96° - ным этиловым спиртом в течение 15-30 минут 3 Промывают физиологическим раствором и наносят 1-2 капли водного раствора (в разведении 1:10000) акридинового оранжевого, затем накрывают покровным стеклом. 4 Проводят люминесцентную микроскопию через 10-20 минут после приготовления препарата. В результате флуорохромирования собственная ДНК в ядре клетки, и вирусная ДНК имеют зелёное свечение в виде гранул различной величины. В препаратах, содержащих РНК – геномные вирусы, и клеточная и вирусная РНК обнаруживаются в цитоплазме клеток в виде красных гранул. Чтобы дифференцировать клеточные нуклеиновые кислоты от вирусных, готовые препараты можно обработать 0,5 %–ным раствором ферментов (ДНК–аза, РНК–аза) в течение 5–10 минут или УФ–лучами. После чего свечение клеточных ДНК или РНК прекращается, а вирусные ДНК или РНК продолжают ещё светиться в течение 20-30 минут. Метод флуорохромирования является простым, однако не позволяет провести идентификацию возбудителя вирусной болезни (определить вид вируса). Методика постановки РИФ (МФА) Подготовительный этап 1 Делают на предметном стекле мазок-отпечаток (из патологического материала или суспензии клеток[3], заражённых вирусом) по общепринятой методике. 2 Высушивают на воздухе и фиксируют в ацетоне, охлаждённом до минус 10-15ºС, или метиловым спирте. При работе с особо–опасными вирусами (например, вирус бешенства и др.) время фиксации может быть увеличено до 10-16 час (не менее 4-х часов). 3 Наносят на готовый препарат один из двух видов конъюгата специфический или антивидовой, в зависимости от варианта реакции: прямой и непрямой вариант РИФ (МФА). 3.1 Прямой вариант РИФ (МФА) (рис. 24) - наносят на подготовленный препарат специфический конъюгат и оставляют на контакт 40–60 минут во влажной камере при температуре 37°С (время контакта можно удлинить до 10-12 часов при температуре +2–8°С); - отмывают физиологическим раствором (рН 7,2-7,5) от конъюгата, если он специфически не связался с антигеном, и высушивают на воздухе; - наносят нефлуоресцирующее иммерсионное масло и проводят люминесцентную микроскопию.
Рис. 24 Схема прямого варианта РИФ (МФА)
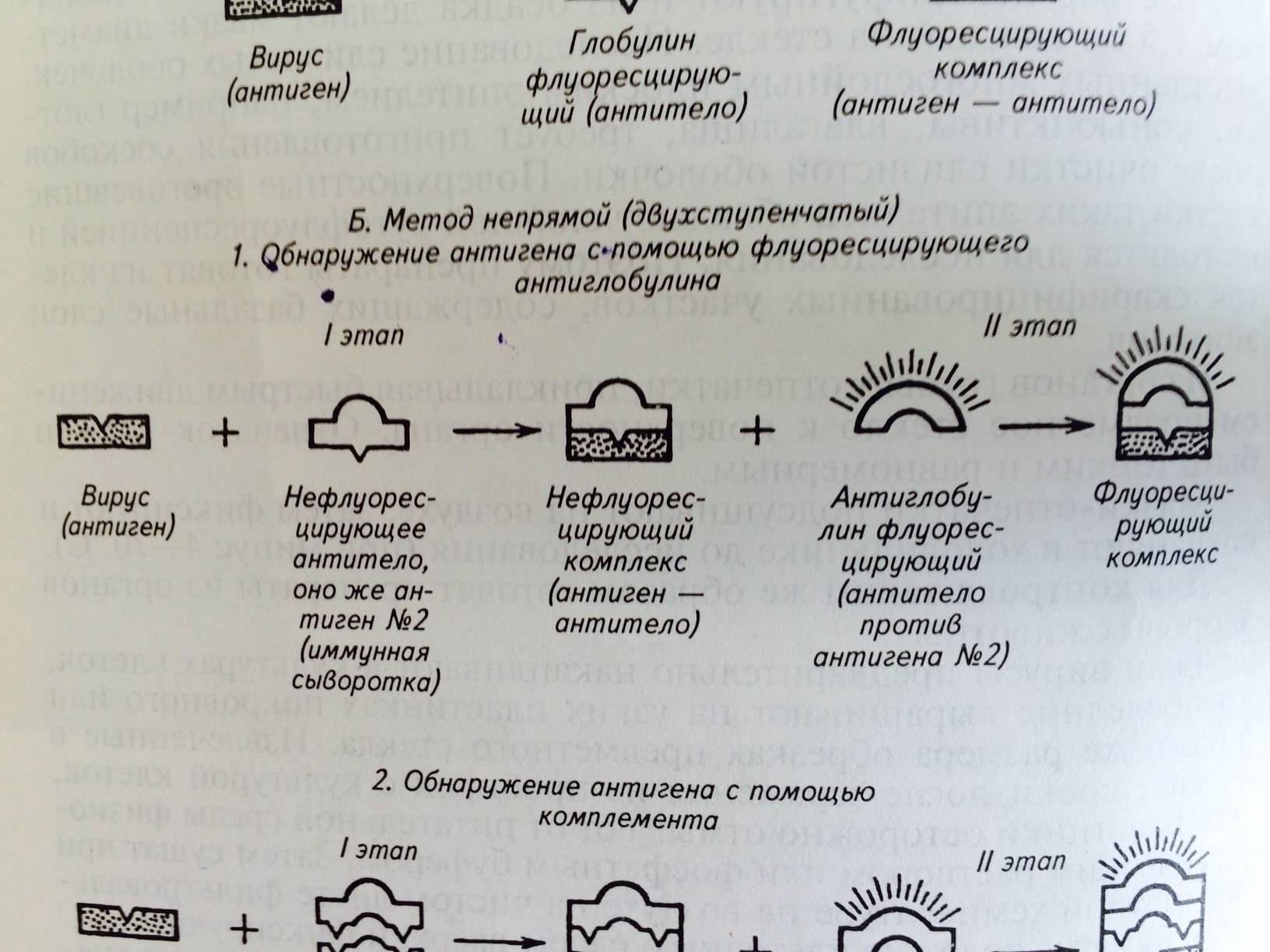
3.2. Непрямой вариант РИФ (МФА) (рис. 25) - наносят на подготовленный препарат специфическую сыворотку (содержит противовирусные антитела) и оставляют на контакт 40–60 минут во влажной камере при температуре 37°С (время контакта можно удлинить до 10–12 часов при температуре +2–8°С); - отмывают физиологическим раствором (рн 7,2–7,5) от антител, если они специфически не связались с антигеном, и высушивают на воздухе; - наносят антивидовой конъюгат и оставляют на контакт 40-60 минут во влажной камере при температуре 37°С (время контакта можно удлинить до 10–12 часов при температуре +2–8°С); - отмывают физиологическим раствором (рН 7,2–7,5) от антивидового конъюгата, если он не связался с антителами в комплексе с антигеном, и высушивают на воздухе; - наносят нефлуоресцирующее иммерсионное масло и проводят люминесцентную микроскопию. В непрямом варианте РИФ (МФА) используют антивидовой конъюгат, который представляет собой антивидовые антитела с флуоресцирующей меткой. Такие антитела выделяют из сыворотки крови животного одного вида (например, лошадь), которому несколько раз вводили глобулиновую фракцию белков, выделенную из сыворотки крови здорового животного другого вида (например, теленок). При этом сыворотка животного того же вида (сыворотка телёнка), использовалась как специфическая к вирусу, исследуемому в РИФ (МФА). Результаты РИФ учитывают по интенсивности и специфичности свечения объекта в крестах, с учётом его локализации, по шкале флуоресценции: яркая сверкающая – «+++»; средняя – «++»; слабая – «+»; полное отсутствие – «–». Признаком положительной РИФ является свечение, оцениваемое от «+++» до «++».
Рис. 25 Схема непрямого варианта РИФ (МФА)
В качестве контролей используют препараты из специфического антигена, который содержит искомый вирус (положительный контроль), и из свободного от вируса материала (отрицательный контроль). Их готовят по той же методике, что и исследуемые, и одновременно с ними.
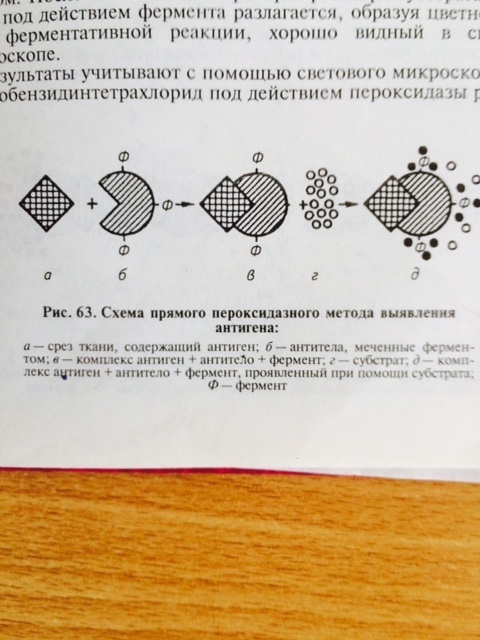
Прямой вариант РИФ позволяет одномоментно проводить индикацию и идентификацию вирусов. При этом для каждого вида вируса требуется конъюгат определённой специфичности. Непрямой вариант РИФ, также применяется в целях индикации и идентификации вирусов. Однако в этом варианте можно использовать один и тот же антивидовой конъюгат для обнаружения антигенов различных вирусов, но поражающих один вид животных. Кроме того, этот вариант РИФ используют для обнаружения антител в сыворотке крови и определения их титра, что не представляется возможным в прямом варианте реакции. К достоинствам РИФ (МФА) относят экспрессность метода, высокую чувствительность и специфичность, возможность ранней диагностики болезни, простоту техники постановки. К недостаткам можно отнести субъективизм в оценке интенсивности свечения. Материальное обеспечение: люминесцентный микроскоп, демонстрационные препараты. Примерный план занятия (2 часа) 1 Проведение тестирования студентов 2 Объяснение преподавателя по теме занятия. 3 Проведение люминесцентной микроскопии демонстрационных препаратов 4 Подведение итогов занятия 5 Задание к следующему занятию Контрольные вопросы 1 Что такое люминесценция? 2 В чём принцип реакции иммунной флуоресценции? 3 Какие Вы знаете варианты РИФ? 4 Как проводят учёт результатов люминесцентной микроскопии? 5 Что такое конъюгат? В каких вариантах РИФ их используют? Тема 12 Реакция иммуноферментного анализа (ИФА) Цель занятия: изучить реакцию иммуноферментного анализа; ознакомится с визуальным учётом результатов иммуноферментного анализа Реакция иммуноферментного анализа – ИФА или другое её название ELISA (от англ. enzyme-linked immunosorbent assay) занимает одно из ведущих мест в современной диагностике и профилактике вирусных болезней человека и животных. ИФА позволяет с высокой степенью достоверности проводить качественное выявление вирусных антигенов в ранней диагностике вирусных болезней и количественную оценку вирусных антигенов при изготовлении вакцин, диагностических препаратов и т.п. ИФА используют и для определения уровня антител в ретроспективной серодиагностике вирусных болезней, при проведении мониторинга эпизоотической обстановки, при изучении механизмов формирования иммунитета и роли различных факторов иммунной системы в патогенезе вирусных болезней. В основе ИФА лежит принцип взаимодействия между антигенами (АГ) вируса и специфическими антителами (АТ), связанными с ферментом (АТ–ф – конъюгат), с образованием комплекса антиген – антитело (АГ–АТ–ф). Индикатором в реакции является ферментно–чувствительное вещество (субстрат), которое при окислении вызывает окрашивание реакционной смеси (рис. 26).
В качестве метки специфических антител при синтезе конъюгата для ИФА часто использую фермент – пероксидазу, полученную из стебля хрена. И тогда на этапе индикации комплекса АГ–АТ-ф вносят смесь из перекиси водорода и хромогена (субстрат). Под действием пероксидазы перекись водорода расщепляется с высвобождением свободного кислорода, который в свою очередь окисляет хромоген с образованием цветного продукта реакции.
Результат реакции можно учитывать визуально. Однако, такой учёт реакции является субъективным и не всегда даёт возможность получить достоверный результат. Наиболее объективный результат получают путём определения оптической плотности раствора в спектрофотометре, которая изменяется в соответствие с повышением концентрации продуктов цветной реакции. Для индикации и идентификации вирусных антигенов чаще других используют вариант ИФА, получивший название – метод двойных антител или «сэндвич» вариант ИФА (рис. 27), в котором в качестве твёрдого носителя используют многолуночные полистироловые планшеты. Методика «сэндвич» варианта ИФА
Для обнаружения антител в сыворотке крови животных и определения титра антител используют непрямой вариант ИФА (рис. 28). Методика непрямого варианта ИФА
Достоинствами метода ИФА является его высокая чувствительность и специфичность, возможность использования в ранней диагностике болезни и в изучении динамики инфекционного процесса. Кроме того, простая методика выполнения реакции, вплоть до полной её автоматизации, позволяет одновременно проводить достаточно большое число исследований. Однако, этот метод не исключает возможность получения и некоторого процента «ложных результатов» исследований, а также требует высоких затрат на высокотехнологичное оборудование и коммерческие тест-системы в особенности зарубежных производителей. Материальное обеспечение: коммерческая тест-система для постановки ИФА; механические дозаторы одно- и восьмиканальные с одноразовыми наконечниками; расходные материалы. Примерный план занятия (2 часа) 1 Проведение тестирования студентов 2 Объяснение преподавателя по теме занятия 3 Демонстрация методики постановки ИФА 4 Самостоятельная работа студентов 5 Подведение итогов занятия 6 Задание к следующему занятию Контрольные вопросы 1 В чём принцип реакции иммуноферментного анализа? 2 Какие задачи можно решать с помощью ИФА? 3 В чём состоит методика сэндвич – ИФА? 4 Какой вариант ИФА используют для титрования сыворотки крови? 5 Как проводят учёт результатов ИФА? 6 Какие есть достоинства и недостатки в методе ИФА?
|
|||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 1062; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.250.241 (0.011 с.) |
||||||||||||||||||||||||||||||||||||

 Рис. 23 Микроскоп люминесцентный Микмед-2-11 (Люмам РПО-11)
Рис. 23 Микроскоп люминесцентный Микмед-2-11 (Люмам РПО-11)
 вирус (антиген) специфический конъюгат флуоресцирующий комплекс
антиген-антитело
вирус (антиген) специфический конъюгат флуоресцирующий комплекс
антиген-антитело
 вирус гомологичная комплекс антивидовой комплекс
(антиген) сыворотка не флуоресцирующий конъюгат флуоресцирующий
вирус гомологичная комплекс антивидовой комплекс
(антиген) сыворотка не флуоресцирующий конъюгат флуоресцирующий
 АГ АТ-ф АГ-АТ-ф субстрат цветное
окрашивание
АГ АТ-ф АГ-АТ-ф субстрат цветное
окрашивание
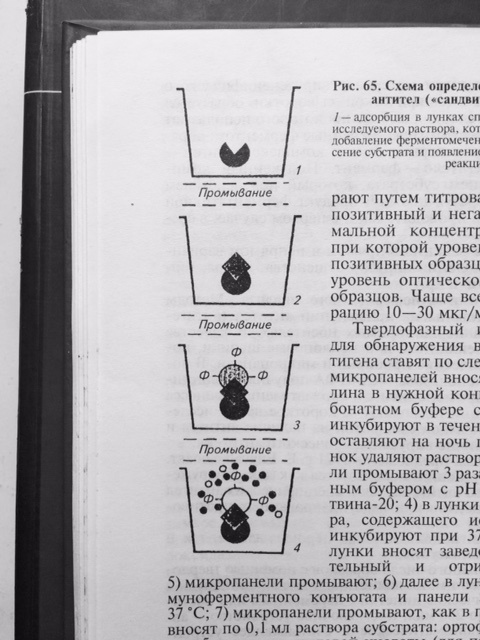
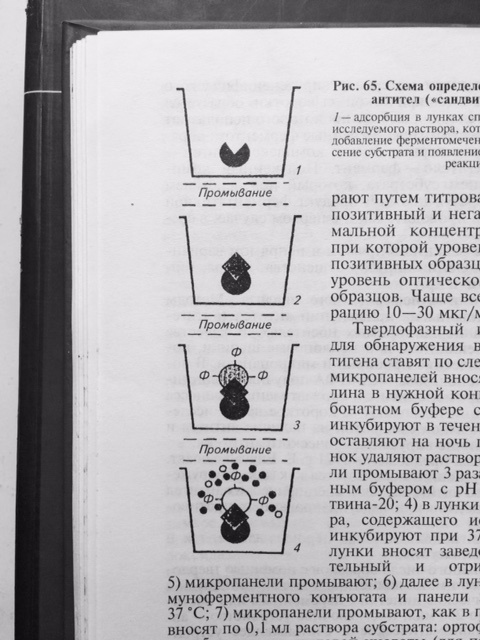
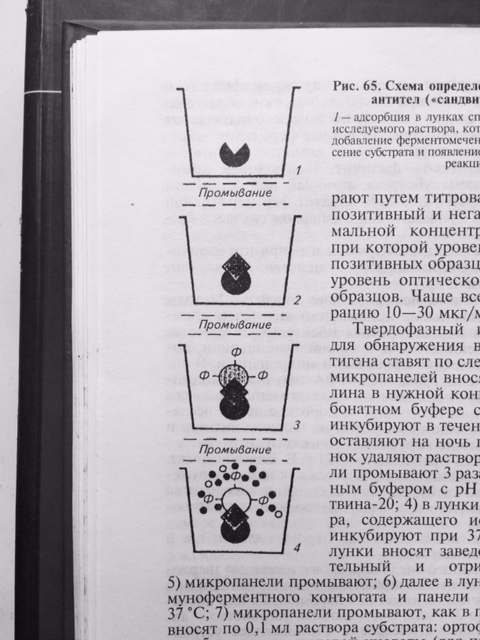
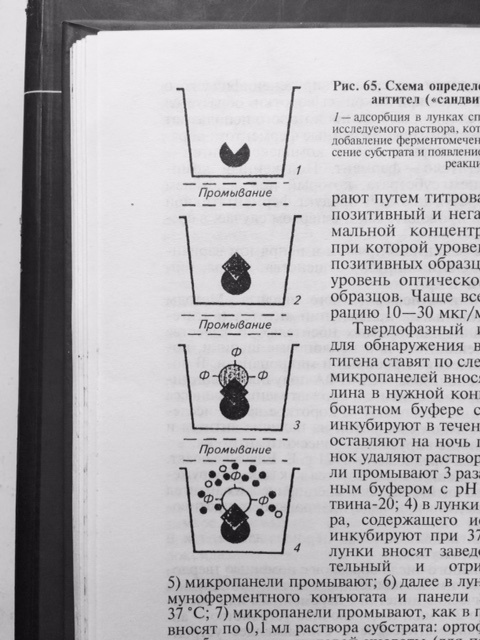 Рис. 27 Схема «сэндвич» варианта ИФА
Рис. 27 Схема «сэндвич» варианта ИФА
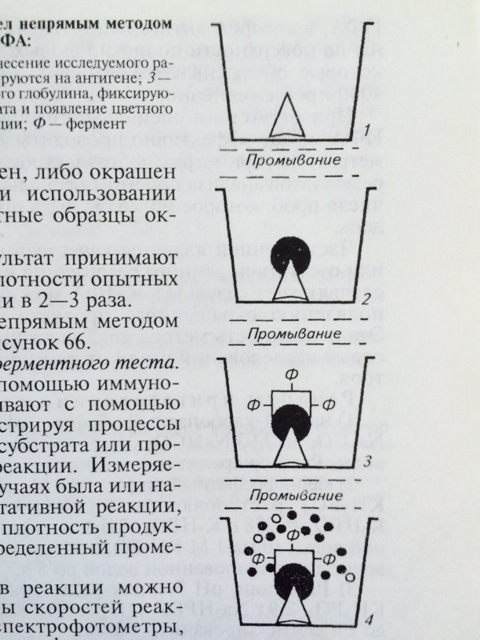
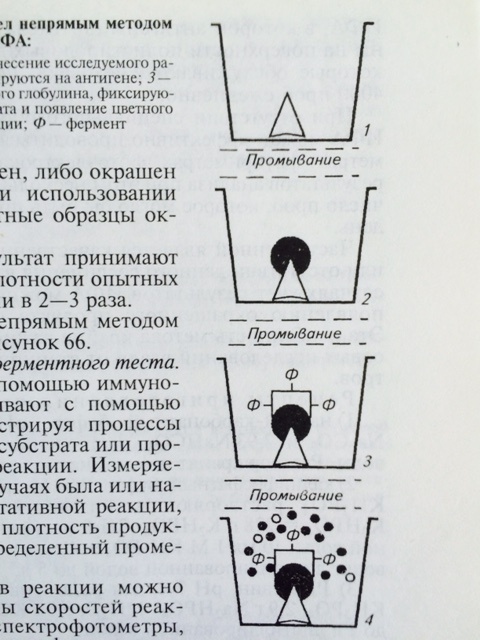
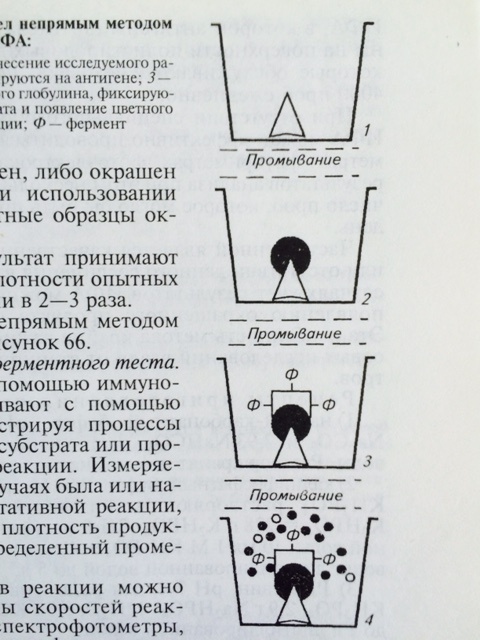
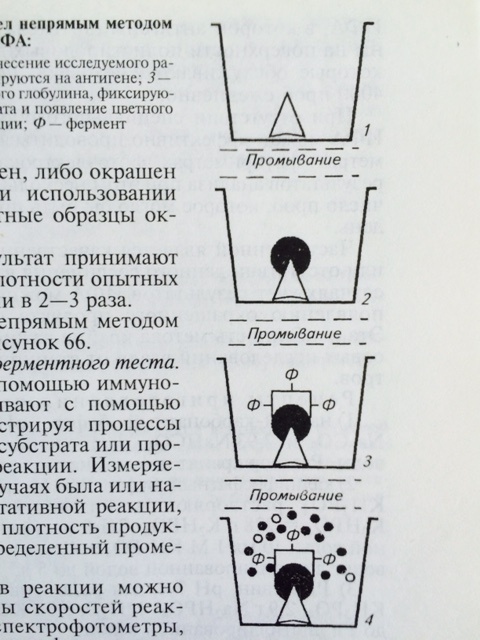 Рис. 28 Схема непрямого варианта ИФА
Рис. 28 Схема непрямого варианта ИФА



