Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 14 Реакция нейтрализации (РН)
Цель занятия: изучить реакцию нейтрализации; овладеть методикой определения титра антител в реакции нейтрализации. Реакция нейтрализации (РН)основана навзаимодействии антигенов вириона вируса с гомологичными антителами с образованием комплекса, что приводит к нейтрализации инфекционной активности вируса. Индикатором инфекционной активности вируса является чувствительная живая система (лабораторные животные, куриные эмбрионы, культура клеток). Чувствительную систему и метод ее заражения выбирают с учетом тропизма вируса (биопроба на тест – объектах). Положительный результат РН учитывают по результатам биопробы: - на лабораторных животных: отсутствует гибель, симптомы болезни и патологические изменения в органах и тканях; - на куриных эмбрионах: отсутствует гибель, патологические изменения в оболочках или тканях зародыша, отрицательная РГА; - в культуре клеток: отсутствуют признаки ЦПД или бляшки, отрицательная РГАд. Так как, не известно, какое количество инфекционных единиц вируса или в каком титре антитела содержатся в исследуемом материале, то перед реакцией готовят последовательные разведения данного материала. Вируссодержащий материал, как правило, разводят с кратностью 10, а сыворотку крови – с кратностью 2. Второй стандартный специфический компонент (референс) берут в реакцию или в постоянном рабочем разведении (сыворотка), или в постоянной рабочей дозе (вирус) соответственно. Для референс–вируса таким стандартом является его инфекционный титр, равный 102ЭД50/мл (103ЭД50/мл). РН используют, во-первых, для идентификации вируса, во-вторых – для обнаружения антител и определения титра антител. Методика идентификации вирусавРН 1Готовят два ряда последовательных 10-кратных разведений исследуемого вируссодержащего материала. 2 Добавляют к каждому разведению вируса первого ряда такой же объём референс – сыворотки (специфическая сыворотка, содержащая антитела против антигенов вируса, который идентифицируют в исследуемом материале) в постоянном рабочем разведении. 3 Добавляют к каждому разведению вируса второго ряда такой же объём отрицательной сыворотки. 4 Оставляют реакционные смеси (вирус + сыворотка) на контакт 90-60 минут при температуре 20°С или 37°С, соответственно.
5 Заражают равными объёмами каждой реакционной смеси (вирус + сыворотка) чётное количество, но не менее 4–х, тест–объектов. 6 Проводят учёт результата биопробы в каждой группе тест–объектов, принимая за положительный результат инфекционное действие вируса, за отрицательный – его отсутствие. 7 Рассчитывают титр вируса в реакционной смеси с отрицательной сывороткой (ТВ+SN) и титр вируса со специфической сывороткой (TВ+SS). 8 Определяют индекс нейтрализации (ИН) вируса по следующей формуле: ИН = ТВ+ SN / T В+ SS ИН показывает, во сколько раз специфическая сыворотка снижает инфекционный титр вируса по сравнению с отрицательной сывороткой. ИН тем больше, чем выше концентрация вируса в исследуемой пробе. Принято, что если: ИН < 101 – результат РН отрицательный 101 < ИН < 102 – результат РН сомнительный ИН > 102 – результат РН положительный
Отрицательный результат РН по индексу нейтрализации свидетельствует о том, что в исследуемом материале отсутствовал вирус, гомологичный специфической сыворотке, т.е. комплекс АГ–АТ между антигенами вируса и специфическими антителами сыворотки в РН не образовывался. Положительный результат РН по индексу нейтрализации свидетельствует о полной гомологии антигенов вируса и специфических антител в сыворотке, т.е. в комплексе АГ–АТ вирус был нейтрализован специфическими антителами сыворотки и полностью утратил инфекционную активность (или репродуцировался с очень низким инфекционным титром). При том, что в присутствие отрицательной сывороткой вирус накапливался в живой системе в высоком инфекционном титре. В случае сомнительного результата реакцию рекомендуется повторить. Методика исследования сыворотки кровивРН Перед реакцией исследуемые пробы сыворотки крови освобождают от термолабильных неспецифических ингибиторов (могут вызывать ложноположительные результаты реакции) методом прогревания на водяной бане в диапазоне температур от 560С до 620С в зависимости от вида хозяина сыворотки: сыворотку крови крупного рогатого скота, лошади, морской свинки и др. – при 560 С; петуха, гуся, утки – при 580 С; крысы, мыши, кролика – при 600 С; овцы, козы – при 620 С.
1Готовят последовательные 2–кратные разведения исследуемой сыворотки. 2 Добавляют к каждому разведению сыворотки равный объём референс – вируса (специфический вирус, антитела против которого определяют в исследуемой сыворотке), имеющего инфекционный титр 102ЭД50/мл или 103Эд50/мл. 3 Оставляют реакционные смеси (вирус + сыворотка) на контакт на 90-60 минут при температуре или 20°С, или 37°С, соответственно. 4 Заражают равными объёмами каждой реакционной смеси чётное количество, но не менее 4-х, тест–объектов. 5 Проводят учёт результата биопробы в каждой группе живых систем, принимая за положительный результат защиту тест–объекта от действия вируса, за отрицательный – инфекционное действие вируса на объект. 6 Рассчитывают разведение сыворотки, в котором она защищает 50% тест–объектов от действия 102ЭД50/мл (103ЭД50/мл). Полученный результат и есть титр вируснейтрализующих антител. Пример расчёта. Требуется определить в РН титр вируснейтрализующих антител в сыворотке крови кролика, иммунизированного вирусом ньюкаслской болезни. В качестве тест – объектов использовали восемь групп куриных эмбрионов (по 4 эмбриона в группе), которым вводили по 0,2 мл реакционной смеси вирус + сыворотка. Сыворотка предварительно была прогрета при температуре 580С и разведена 2– кратно от 1:2 до 1: 256, вирус ньюкаслской болезни имел титр 102ЭЛД50/мл. Результат биопробы (табл. 12) учитывали по гибели эмбрионов: положительный - эмбрионы живые (есть защита сывороткой), отрицательный – гибель эмбрионов (нет защиты). Таблица 12 Результаты титрования сыворотки в РН
По формуле Кербера рассчитываем разведение сыворотки, в котором она защищает 50% куриных эмбрионов от 102ЭЛД50/мл вируса ньюкаслской болезни: lg ЭД 50 = lg D + lg d / 2 – lg d • Σ r / n где ЭД50 – искомое разведение сыворотки; D – наибольшее разведение сыворотки, еще обеспечивающее 100 % – ый эффект защиты от вируса; d – коэффициент разведения сыворотки; Σr / n – отношение суммы тест-объектов, положительно реагирующих на сыворотку (Σr = r 1 + r 2 + r 3 + …. rn), к количеству объектов в группе (n). lg ЭД50 = – 0,6 + 0,3/2 – 0,3 • (0+1+1+2+2+3+4) / 4 lg ЭД50 = – 0,6 + 0,15 – 0,3 • 3,25 = – 0,45 – 0,975 = – 1,425 Таким образом, исследуемая сыворотка в разведении 1: 10 1,425 (10 – 1,425) защищает 50% куриных эмбрионов от 102ЭД50/мл вируса ньюкаслской болезни. По таблице десятичных антилогарифмов 10 1,425 соответствует значению 26,5. Титр вируснейтрализующих антител в исследуемой сыворотке – 1: 26,5 Достоинством РН является ее высокая специфичность и достоверность результатов. Это позволяет считать её «золотым стандартом» в серологических исследованиях. К недостаткам РН относят трудоемкость реакции. В частности, необходимо соблюдение стерильных условий, использование живых систем, длительное наблюдение за биопробой. а также статистическая обработка полученных данных.
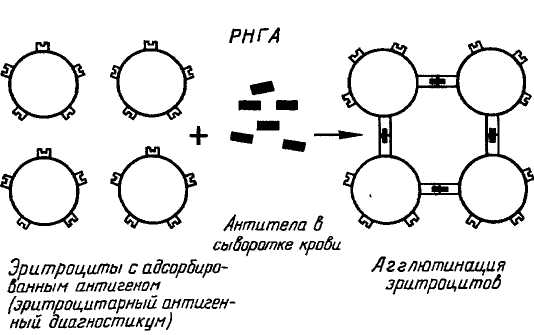
Данную реакцию не относят к экспресс – методам исследования, т.к. перед её постановкой требуется провести индикацию вируса в патологическом материале методом биопробы в живой системе. Материальное обеспечение: матрасы с культурой клеток не зараженной и с признаками ЦПД, фиксированной в спиртовом растворе формалина, микроскопы учебные; осветители. Примерный план занятия (2 часа) 1 Проведение тестирования студентов 2 Объяснение преподавателя по теме занятия 3 Самостоятельная работа студентов: проведение световой микроскопии результатов биопробы на культуре клеток и определение титра вируснейтрализующих антител в сыворотке по формуле Кербера 4 Подведение итогов занятия 5 Задание к следующему занятию Контрольные вопросы 1 В чем принцип реакции нейтрализации? 2 В чём состоит методика титрования сыворотки крови в реакции нейтрализации? 3 С какой целью рассчитывают индекс в реакции нейтрализации? 4 В чём вы видите достоинства и недостатки реакции нейтрализации? Тема 15 Реакция непрямой (пассивной) гемагглютинации (РНГА) Цель занятия: изучить реакцию непрямой гемагглютинации; ознакомиться с методами производства эритроцитарных диагностикумов; овладеть методикой определения титра антител в реакции непрямой гемагглютинации. Реакция непрямой гемагглютинации (РНГА) заключается в том, что эритроциты, на которых предварительно и необратимо адсорбированы или специфические антигены вируса, или специфические противовирусные антитела, приобретают способность агглютинироваться в присутствии или гомологичных антител, или гомологичных антигенов вируса. Реакцию учитывают визуально по агглютинации эритроцитов, которые используются в реакции как носители адсорбированных на них специфических белков (АГ или АТ). Положительный результат РНГА – это «зонтик», отрицательный – «пуговка». Следует отличать РНГА от РГА. В РГА эритроциты агглютинируются в результате взаимодействия их рецепторов с гемагглютинирующими белками вируса (гемагглютитнины) (рис. 30), в РНГА – через комплекс АГ–АТ (рис. 31).
Рис. 30 Схема реакции гемагглютинации (РГА)
Рис. 31 Схема реакции непрямой гемагглютинации Эритроциты, сенсибилизированные вирусными антигенами, называются эритроцитарным антигенным диагностикумом. Он используется в РНГА для обнаружения антител в сыворотке крови и определения титра антител. Эритроциты, сенсибилизированные специфическими антителами, называются эритроцитарным антительным диагностикумом. Он используется в РНГА для индикации и идентификации вирусов. Этапы приготовления эритроцитарных диагностикумов 1 Получают эритроциты от барана или птицы (куры, индейки, утки) по общепринятой методике. 2 Стабилизируют эритроциты 50,0 %-ным раствором формалина. Для этого 50 %-ную взвесь отмытых изотоническим раствором хлорида натрия и осаждённых центрифугированием при 1000 об/мин. в течение 15 мин. эритроцитов соединяют с равным объёмом (1:1) 50,0 %-ного раствора формалина. Инкубируют при 37°С в течение двух часов с периодическим перемешиванием через каждые 30 мин. Затем трижды отмывают 0,15 М раствором NaCl (рН 7,2). 3 Танизируют эритроциты путём смешивания равных объёмов (1:1) 3,0 %-ной взвеси эритроцитов на физиологическом растворе (рН 7,2) и раствора танина в разведении 1:20 000. Инкубируют 10-15 мин. при 37°С и центрифугируют при 1000 об/мин. в течение 15 мин. Удаляют надосадочную жидкость, осадок танизированных эритроцитов трёхкратно промывают фосфатным буферным раствором (рН 7,2). 4 Готовят для сенсибилизации 10 %-ную взвесь эритроцитов на 0,15 М фосфатном буфере (рН 6,4) и смешивают с равным объёмом (1:1) специфических вирусных антигенов. Инкубируют 60 минут при температуре 37° С, перемешивая через каждые 15 мин. Затем центрифугируют при 1000 об/мин. в течение 15 мин. и трижды промывают фосфатным буферным раствором (рН 7,2). 5 Разводят осадок сенсибилизированных эритроцитов до 1,0 %-ного раствора в фосфатном буферном растворе (рН 7,2) с добавлением одного процента сыворотки кролика (для стабилизации эритроцитов). 6 Хранят готовые эритроцитарные диагностикумы при температуре +2-+8° С и используют в РНГА в соответствии с инструкцией по применению. Методика определения титра антител в РНГА с использованием эритроцитарного антигенного диагностикума РНГА ставят микрометодом в специальных иммунологических 96-луночных планшетах. 1 Готовят последовательные двукратные разведения исследуемой пробы сыворотки крови. Для этого в лунки вносят по 50,0 мкл физиологического раствора (рН 7,2). В лунку № 1 вносят 50,0 мкл исследуемой сыворотки, перемешивают и переносят 50,0 мкл в лунку № 2, перемешивают и 50,0 мкл переносят в лунку № 3 и так далее до пятой лунки. Из лунки № 5 после перемешивания удаляют 50,0 мкл разведённой сыворотки (1:32). 2 Одновременно в лунках №№ 6, 7, 8, 9 ставят следующие контроли: в лунку № 6 (контроль исследуемой сыворотки крови на наличие гемагглютининов) вносят 50,0 мкл физиологического раствора и 50,0 мкл неразведённой сыворотки крови; в лунку № 7 (контроль эритроцитарного диагностикума на самоагглютинацию) вносят 50,0 мкл физиологического раствора; в лунку № 8 (контроль активности эритроцитарного диагностикума) вносят 50,0 мкл физиологического раствора и 50,0 мкл сыворотки специфической (SS); в лунку № 9 (контроль специфичности эритроцитарного диагностикума) вносят 50,0 мкл физиологического раствора и 50,0 мкл сыворотки отрицательной (SN).
3 Вносят во все лунки (кроме лунки № 6) 50,0 мкл эритроцитарного антигенного диагностикума (ЭAS), в лунку № 6 - 50,0 мкл не сенсибилизированных эритроцитов. 4 Инкубируют 1 час при комнатной температуре. 5 Учитывают результаты РНГА по гемагглютинации 6 Определяют титр антител в исследуемой сыворотке крови За титр антител в РНГА принимают то наибольшее разведение сыворотки крови, которое ещё вызывает агглютинацию сенсибилизированных эритроцитов не менее, чем на два креста (++). Протокол определения титра антител в РНГА представлен в таблице 13. Таблица 13 Протокол определения титра антител в РНГА
Компоненты Реакции |
Разведения сыворотки Sх |
КОНТРОЛИ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1:2 | 1:4 | 1:8 | 1:16 | 1:32 | SX |
ЭА S | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 Физ.р-р (мкл) | 50,0 | 50,0 | 50,0 | 50,0 | 50,0 |
50,0 |
50,0 |
50,0 | 50,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 Исследуемая сыворотка Sх | 50,0 |
Перенос по 50,0 |
50,0 | – | – | – | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 Сыворотка специфическая SS | – | – | – | – | – | – | – |
50,0 | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 Сыворотка отрицательная SN | – | – | – | – | – | – | – | – | 50,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 ЭА S | 50,0 | 50,0 | 50,0 | 50,0 | 50,0 | – |
50,0 |
50,0 | 50,0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 Эр. не сенси- билизированные | – | – | – | – | – |
50,0 | – | – | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 Учёт результата | +++ | ++ | ++ | – | – | – | – | +++ | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Согласно результатам агглютинации сенсибилизированных эритроцитов, титр антител в сыворотке S х равен 1: 8 - большее из двух разведений сыворотки с агглютинацией на ++ (табл.13).
РНГА относится экспресс - методу, характеризуется высокой чувствительностью и специфичностью, даёт возможность проводить раннюю диагностику болезни, а также отличается простой методикой выполнения и не требует стерильных условий.
Однако следует отметить, что качество и стабильность эритроцитарных диагностикумов напрямую зависит от степени очистки антигенов, а также от индивидуально подобранных для каждого антигена вируса условий фиксации, танизации и сенсибилизации эритроцитов.
Материальное обеспечение: эритроцитарный антигенный диагностикум; исследуемая сыворотка крови; иммунологические планшеты; физиологический раствор; дистиллированная вода; механические дозаторы одноканальные с одноразовыми наконечниками; расходные материалы.
Примерный план занятия (2 часа)
1 Проведение тестирования студентов
2 Объяснение преподавателя по теме занятия.
3 Демонстрация: а) диагностического набора для РНГА; б) методики постановки РНГА.
4 Самостоятельная работа студентов: а) постановка РНГА; б) учёт результатов РНГА; в) определение титра антител в сыворотке крови..
5 Подведение итогов занятия
6 Задание к следующему занятию
Контрольные вопросы
1 В чём принцип реакции непрямой гемагглютинации?
2 В чём отличие непрямой гемагглютинации от прямой?
3 В чём заключается методика РНГА для определения титра антител в сыворотки крови?
4 В чём достоинства и недостатки РНГА?
Тема 16 Реакция торможения (задержки) гемагглютинации (РТГА)
Цель занятия: изучить реакцию торможения гемагглютинации; овладеть методикой определения титра антител в реакции торможения гемагглютинации.
Реакция торможения (задержки) гемагглютинации (РТГА, РЗГА)основана на том, что антитела при взаимодействии с гомологичными антигенами гемагглютинирующих вирусов образуют комплекс антиген – антитело, в котором вирус утрачивает не только инфекционную, но и гемагглютинирующую активность. В качестве индикатора свободного не связавшегося вируса в реакции используют эритроциты, которые получены от животного того вида, в отношении которого вирус проявляет агглютинирующую активность. Признаком положительной реакции является отсутствие (торможение или задержка) геммаггютинации.
РТГА используют, во-первых, для идентификации вируса, во-вторых – для обнаружения антител и определения титра антител.
Так как, не известно, какое количество антигена гемагглютинирующего вируса или в каком титре антитела содержатся в исследуемом материале, то перед реакцией данный материал разводят с кратностью 2. Второй стандартный специфический компонент (референс) берут в реакцию или в постоянном рабочем разведении (сыворотка), или в постоянной рабочей дозе (вирус) соответственно. Для референс–вируса таким стандартом является его гемагглютинирующий титр, равный 4 ГАЕ.
Методика определения титра антител в РТГА (табл.14)
РТГА ставят микрометодом в специальных иммунологических 96-луночных планшетах.
1 Готовят последовательные двукратные разведения исследуемой пробы сыворотки крови. Для этого вносят в лунки с № 1 по № 5 по 50,0 мкл физиологического раствора (рН 7,2), далее в лунку № 1 вносят 50,0 мкл исследуемой сыворотки, перемешивают и переносят 50,0 мкл в лунку № 2, перемешивают и 50,0 мкл переносят в лунку № 3 и так далее до пятой лунки. Удаляют из лунки № 5 после перемешивания 50,0 мкл сыворотки в разведении 1:32.
2 Добавляют к каждому разведению сыворотки по 50,0 мкл 4 ГАЕ референс–вируса.
3 Ставят одновременно следующие контроли в лунках №№ 6, 7, 8, 9, 10, 11: в лунке № 6 (контроль исследуемой сыворотки крови на наличие гемагглютининов) – вносят 50,0 мкл физиологического раствора и 50,0 мкл неразведённой сыворотки крови; в лунке № 7 (контроль эритроцитов на самоагглютинацию) – вносят 100,0 мкл физиологического раствора; в лунках № 8,9,10,11 (контроль рабочей дозы вируса – 4 ГАЕ) – вносят 50,0 мкл физиологического раствора, затем в лунку № 8 вносят 50,0 мкл вируса в титре 4 ГАЕ, перемешивают и переносят 50,0 мкл в лунку № 9, перемешивают и 50,0 мкл переносят в лунку № 10, перемешивают и переносят в лунку № 11. Из лунки № 11 после перемешивания удаляют 50,0 мкл вируса.
4 Инкубируют 30-40 мин. при комнатной температуре.
5 Вносят во все лунки по 50,0 мкл 1,0% -ной суспензии эритроцитов.
6 Инкубируют 15 – 20 мин. при комнатной температуре
7 Учитывают результат по гемагглютинации
8 Определяют титр антител в исследуемой сыворотке крови
За титр антител в РТГА принимают наибольшее разведение сыворотки, которое ещё полностью тормозит гемагглютинацию.
Таблица 14
Протокол титрования сыворотки в РТГА
| №№ лунок | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | ||||||
Компоненты
Реакции
Разведения сыворотки SХ
КОНТРОЛИ
1:2
1:4
1:8
1:16
1:32
Эр
SХ
АГ (вируса) ГАЕ
50,0
50,0
50,0
50,0
100
Перенос по 50,0
-
50,0
50,0
50,0
Перенос по 50,0
Контакт 30-40 мин. при комнатной температуре
50,0
50,0
50,0
50,0
50,0
|
| Поделиться: |
Последнее изменение этой страницы: 2021-01-08; просмотров: 1154; Нарушение авторского права страницы; Мы поможем в написании вашей работы!
infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.165.247 (0.11 с.)