Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика проведения ПЦР-анализаСодержание книги
Поиск на нашем сайте
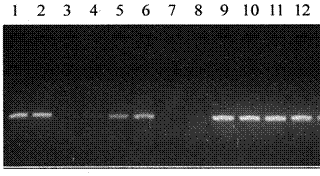
ПЦР-анализ состоит из трёх этапов: выделения нуклеиновых кислот вируса, амплификации, детекции продуктов амплификации. Подготовку проб проводят в соответствии с инструкцией к тест-системе. Нуклеиновые кислоты вирусов выделяют из 100,0 мкл вируссодержащей суспензии с помощью комплекта для выделения ДНК. Этап I - выделение ДНК вирусов Цель выделения ДНК вируса– концентрирование в малом объёме (100,0 мкл), удаление ингибиторов ПЦР и получение очищенного препарата ДНК. Для этого 100,0 мкл подготовленной пробы помещают в лизирующий раствор для лизиса клеток и деструкции нуклеопротеидных комплексов. Затем ДНК сорбируют на сорбенте, проводят инактивацию эндогенных и экзогенных нуклеаз (ферменты, разрушающие нуклеиновые кислоты) и удаляют ингибиторы ПЦР путём трёхкратных отмывок. После элюции ДНК (десорбирование) получают очищенный препарат суммарной ДНК. Пробы готовы к постановке ПЦР. Этап II - постановка реакции амплификации Предварительно готовят пробирки с реакционной смесью компонентов для постановки амплификации в соответствии с инструкцией к тест-системе. Реакционная смесь состоит из следующих компонентов: буферного раствора, четырёх видов дезоксинуклеотидтрифосфатов, праймеров, ДНК-полимеразы, хлорида магния, исследуемого препарата суммарной ДНК. На поверхность реакционной смеси наносят каплю минерального масла для предотвращения её испарения. Объём реакционной смеси составляет 25,0 мкл. Подготовленные пробирки помещают в лунки амплификатора, запускают программу в соответствии с инструкцией к тест-системе. После окончания реакции пробирки готовы к анализу продуктов ПЦР методом горизонтального электрофореза. Этап III - электрофоретический анализ продуктов ПЦР Электрофоретический анализ продуктов ПЦР заключается в разделении фрагментов ДНК по молекулярной массе в агарозном геле. Для этого готовят рабочий электрофорезный буфер и расплавляют агарозу. Агарозный гель заливают в форму электрофоретической камеры, устанавливают гребёнки для получения лунок и дают полностью застыть (30 минут при комнатной температуре). Далее осторожно вынимают гребенки, не повредив лунки. Помещают подложку с готовым гелем в камеру. Лунки должны располагаться ближе к отрицательному электроду, т.к. ДНК перемещается по направлению к положительному. Заливают в камеру готовый буфер так, чтобы он покрывал гель на 5,0 мм сверху. После амплификации отбирают из пробирок по 10,0 – 15,0 мкл проб и вносят в лунки геля. В каждом ряду дорожек (трек) геля должен быть обязательно представлен положительный и отрицательный контроли. После электрофореза переносят гель на трансиллюминатор, расположив полосы горизонтально лунками вверх. При просматривании геля глаза и лицо должны быть защищены специальной маской или стеклянной пластиной. Учёт и интерпретация результатов Учет результатов ПЦР-анализа проводится по наличию или отсутствию на электрофореграмме специфических полос амплифицированной ДНК. Учет следует начинать с результатов амплификации контролей. В дорожке, соответствующей положительному контролю, должна быть яркая специфическая светящаяся полоса на определённом уровне. В дорожках, соответствующих отрицательным контролям, такая полоса отсутствует. Положительными считаются образцы, которые содержат специфическую светящуюся полосу большей или меньшей интенсивности на том же уровне, что и полоса с положительным контрольным образцом ДНК. Отрицательными считаются пробы, в дорожках которых отсутствует специфическая полоса (рис.32).
Рис. 32 Электрофореграмма результатов ПЦР Результаты анализа не учитывают, если в дорожке отрицательного контроля выявляется специфическая полоса. Возможно, произошла контаминация реактивов и (или) проб. В этом случае результаты анализа считаются недействительными. Требуется повторить анализ проб, а также принять меры по выявлению источника контаминации. Материальное обеспечение: диагностическая тест-система для диагностики вирусных болезней животных методом ПЦР, настольный ПЦР-бокс, амплификатор, твердотельный термостат для пробирок типа «эппендорф» на 25 – 100° С, вакуумный отсасыватель с колбой-ловушкой, микроцентрифуга для микропробирок типа «эппендорф» до 12 - 16 тыс. g, центрифуга/вортекс, камера для горизонтального электрофореза, источник постоянного тока с напряжением 150-460 В, ультрафиолетовый трансиллюминатор, набор автоматических пипеток переменного объема, одноразовые полипропиленовые пробирки на 1,5 мл, штативы для микропробирок, наконечников, одноразовые наконечники для пипеток переменного объемадо 200,0 и до 1000,0 мкл, ёмкость с дезинфицирующим раствором. Примерный план занятия (2 часа) 1 Проведение тестирования студентов 2 Объяснение преподавателя по теме занятия. 3 Демонстрация преподавателя по выделению ДНК из пробы, постановка амплификации, проведение горизонтального электрофореза, интерпретация полученных результатов. 4 Подведение итогов занятия 5 Задание к следующему занятию Контрольные вопросы 1 В чём заключается принцип полимеразной цепной реакции? 2 Из каких этапов состоит ПЦР-анализ? 3 В чём заключается методика выделения ДНК? 4 В чём состоит методика амплификации? 5 Как интерпретируют результаты ПЦР?
Приложение 1
|
||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 193; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.32.238 (0.006 с.) |