Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 1 Техника безопасности при работе с вирусамиСодержание книги
Поиск на нашем сайте
Введение Вирусы – это мельчайшие возбудители инфекционных болезней человека, животных, растений, которые не имеют клеточного строения, содержат собственный генетический материал, репродуцируются только в живых клетках «хозяина» и могут существовать вне клетки в форме вирионов. Вирионы вирусов внедряют свой генетический материал в другие клетки или в другой организм и становятся внутриклеточными генетическими паразитами. Заболевания, вирусная природа которых в настоящее время установлена, в течение многих столетий наносили значительный ущерб сельскому хозяйству и вред здоровью человека. Многие из них были описаны уже давно, однако, попытки установить их причину и обнаружить возбудителя долгое время оставались безуспешными. Открытие вирусов принадлежит русскому учёному ботанику – Дмитрию Иосифовичу Ивановскому (1864 – 1920 гг.). Он доказал существование нового типа возбудителя - вируса мозаичной болезни табака на основе единственной его физико-химической характеристики. Этот возбудитель обладал способностью «проходить» через бактериальные фильтры, т.е. был намного меньше бактериальной клетки. Позднее Лефлером и Фрошем был открыт вирус ящура (1897 г.), Ридом и Кэрролом - вирус желтой лихорадки (1898 г.). Новые агенты получили название вирус (virus), что означало «заразный яд». Среди объектов живой природы наряду с про – и эукариотами они составили «третье царство», условно названное Vira. По мере изучения их природы формировались представления о вирусах, как мельчайших биологических агентах, способных к размножению и обладающих наследственностью. Создание электронного микроскопа позволило увидеть вирусы и получить их изображение. Дальнейшее развитие естественных наук на молекулярном уровне значительно стимулировало развитие вирусологии. Молекулярные методы исследования показали, что как и в клетках про– и эукариот, генетическая информация у вирусов заключена в нуклеиновых кислотах. Однако, если у первых генетическую информацию несут только молекулы ДНК, то у вирусов – оба типа нуклеиновых кислот – и ДНК, и РНК. На основании этого различают ДНК – геномные и РНК – геномные вирусы. Дальнейшее изучение молекулярной биологии вирусов показало определённое противоречие раннему представлению о вирусах, как микроорганизмах. Так, у вирусов отсутствует обмен веществ, собственные белоксинтезирующие (рибосомы) и энергетические (митохондрии) системы. В отличие от бактерий и простейших вирусы являются генетическими паразитами и «конкурируют» с геномом самой клетки. Нуклеиновые кислоты вирусов довольно разнообразны. По форме они бывают линейными или кольцевыми (циркулярными), по количеству цепей – одноцепочечными или двуцепочечными, а также непрерывными или фрагментированными (сегментированными). Они заключены в капсид из белковых молекул и называются простыми (безоболочечными) вирусами. Однако, у некоторых вирусов есть дополнительная внешняя суперкапсидная оболочка – пеплос, состоящая из вирусных белков, а также углеводов и липидов самой клетки и они называются сложными (оболочечными) вирусами. Вирусы репродуцируются только в клетках и по своему уникальному способу, который отличается от размножения всех других клеток и организмов (бинарное деление, почкование и др.). Он получил название – дизъюнктивный, т.е. разобщённый в пространстве, когда одни структуры вириона синтезируются в ядре, другие – в цитоплазме клеток; и во времени, когда вначале синтезируются вирусные белки, затем нуклеиновых кислот, и только после этого происходит сборка вирионов и их выход из клеток. Тема 4 Культивирование вирусов. Тема 11 Серологические реакции в вирусологии. Тема 12 Реакция иммуноферментного анализа (ИФА) Цель занятия: изучить реакцию иммуноферментного анализа; ознакомится с визуальным учётом результатов иммуноферментного анализа Реакция иммуноферментного анализа – ИФА или другое её название ELISA (от англ. enzyme-linked immunosorbent assay) занимает одно из ведущих мест в современной диагностике и профилактике вирусных болезней человека и животных. ИФА позволяет с высокой степенью достоверности проводить качественное выявление вирусных антигенов в ранней диагностике вирусных болезней и количественную оценку вирусных антигенов при изготовлении вакцин, диагностических препаратов и т.п. ИФА используют и для определения уровня антител в ретроспективной серодиагностике вирусных болезней, при проведении мониторинга эпизоотической обстановки, при изучении механизмов формирования иммунитета и роли различных факторов иммунной системы в патогенезе вирусных болезней. В основе ИФА лежит принцип взаимодействия между антигенами (АГ) вируса и специфическими антителами (АТ), связанными с ферментом (АТ–ф – конъюгат), с образованием комплекса антиген – антитело (АГ–АТ–ф). Индикатором в реакции является ферментно–чувствительное вещество (субстрат), которое при окислении вызывает окрашивание реакционной смеси (рис. 26).
В качестве метки специфических антител при синтезе конъюгата для ИФА часто использую фермент – пероксидазу, полученную из стебля хрена. И тогда на этапе индикации комплекса АГ–АТ-ф вносят смесь из перекиси водорода и хромогена (субстрат). Под действием пероксидазы перекись водорода расщепляется с высвобождением свободного кислорода, который в свою очередь окисляет хромоген с образованием цветного продукта реакции. Результат реакции можно учитывать визуально. Однако, такой учёт реакции является субъективным и не всегда даёт возможность получить достоверный результат. Наиболее объективный результат получают путём определения оптической плотности раствора в спектрофотометре, которая изменяется в соответствие с повышением концентрации продуктов цветной реакции. Для индикации и идентификации вирусных антигенов чаще других используют вариант ИФА, получивший название – метод двойных антител или «сэндвич» вариант ИФА (рис. 27), в котором в качестве твёрдого носителя используют многолуночные полистироловые планшеты. Методика «сэндвич» варианта ИФА
Для обнаружения антител в сыворотке крови животных и определения титра антител используют непрямой вариант ИФА (рис. 28). Методика непрямого варианта ИФА
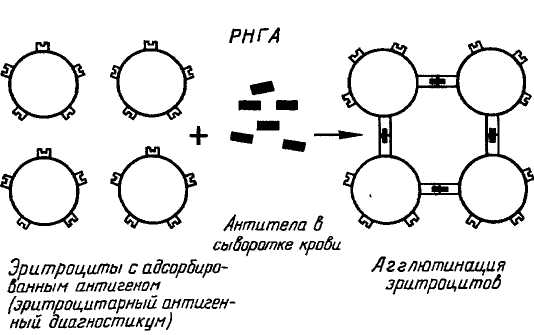
Достоинствами метода ИФА является его высокая чувствительность и специфичность, возможность использования в ранней диагностике болезни и в изучении динамики инфекционного процесса. Кроме того, простая методика выполнения реакции, вплоть до полной её автоматизации, позволяет одновременно проводить достаточно большое число исследований. Однако, этот метод не исключает возможность получения и некоторого процента «ложных результатов» исследований, а также требует высоких затрат на высокотехнологичное оборудование и коммерческие тест-системы в особенности зарубежных производителей. Материальное обеспечение: коммерческая тест-система для постановки ИФА; механические дозаторы одно- и восьмиканальные с одноразовыми наконечниками; расходные материалы. Примерный план занятия (2 часа) 1 Проведение тестирования студентов 2 Объяснение преподавателя по теме занятия 3 Демонстрация методики постановки ИФА 4 Самостоятельная работа студентов 5 Подведение итогов занятия 6 Задание к следующему занятию Контрольные вопросы 1 В чём принцип реакции иммуноферментного анализа? 2 Какие задачи можно решать с помощью ИФА? 3 В чём состоит методика сэндвич – ИФА? 4 Какой вариант ИФА используют для титрования сыворотки крови? 5 Как проводят учёт результатов ИФА? 6 Какие есть достоинства и недостатки в методе ИФА? Тема 15 Реакция непрямой (пассивной) гемагглютинации (РНГА) Цель занятия: изучить реакцию непрямой гемагглютинации; ознакомиться с методами производства эритроцитарных диагностикумов; овладеть методикой определения титра антител в реакции непрямой гемагглютинации. Реакция непрямой гемагглютинации (РНГА) заключается в том, что эритроциты, на которых предварительно и необратимо адсорбированы или специфические антигены вируса, или специфические противовирусные антитела, приобретают способность агглютинироваться в присутствии или гомологичных антител, или гомологичных антигенов вируса. Реакцию учитывают визуально по агглютинации эритроцитов, которые используются в реакции как носители адсорбированных на них специфических белков (АГ или АТ). Положительный результат РНГА – это «зонтик», отрицательный – «пуговка». Следует отличать РНГА от РГА. В РГА эритроциты агглютинируются в результате взаимодействия их рецепторов с гемагглютинирующими белками вируса (гемагглютитнины) (рис. 30), в РНГА – через комплекс АГ–АТ (рис. 31).
Рис. 30 Схема реакции гемагглютинации (РГА)
Рис. 31 Схема реакции непрямой гемагглютинации Эритроциты, сенсибилизированные вирусными антигенами, называются эритроцитарным антигенным диагностикумом. Он используется в РНГА для обнаружения антител в сыворотке крови и определения титра антител. Эритроциты, сенсибилизированные специфическими антителами, называются эритроцитарным антительным диагностикумом. Он используется в РНГА для индикации и идентификации вирусов. Этапы приготовления эритроцитарных диагностикумов 1 Получают эритроциты от барана или птицы (куры, индейки, утки) по общепринятой методике. 2 Стабилизируют эритроциты 50,0 %-ным раствором формалина. Для этого 50 %-ную взвесь отмытых изотоническим раствором хлорида натрия и осаждённых центрифугированием при 1000 об/мин. в течение 15 мин. эритроцитов соединяют с равным объёмом (1:1) 50,0 %-ного раствора формалина. Инкубируют при 37°С в течение двух часов с периодическим перемешиванием через каждые 30 мин. Затем трижды отмывают 0,15 М раствором NaCl (рН 7,2). 3 Танизируют эритроциты путём смешивания равных объёмов (1:1) 3,0 %-ной взвеси эритроцитов на физиологическом растворе (рН 7,2) и раствора танина в разведении 1:20 000. Инкубируют 10-15 мин. при 37°С и центрифугируют при 1000 об/мин. в течение 15 мин. Удаляют надосадочную жидкость, осадок танизированных эритроцитов трёхкратно промывают фосфатным буферным раствором (рН 7,2). 4 Готовят для сенсибилизации 10 %-ную взвесь эритроцитов на 0,15 М фосфатном буфере (рН 6,4) и смешивают с равным объёмом (1:1) специфических вирусных антигенов. Инкубируют 60 минут при температуре 37° С, перемешивая через каждые 15 мин. Затем центрифугируют при 1000 об/мин. в течение 15 мин. и трижды промывают фосфатным буферным раствором (рН 7,2). 5 Разводят осадок сенсибилизированных эритроцитов до 1,0 %-ного раствора в фосфатном буферном растворе (рН 7,2) с добавлением одного процента сыворотки кролика (для стабилизации эритроцитов). 6 Хранят готовые эритроцитарные диагностикумы при температуре +2-+8° С и используют в РНГА в соответствии с инструкцией по применению. Методика определения титра антител в РНГА с использованием эритроцитарного антигенного диагностикума РНГА ставят микрометодом в специальных иммунологических 96-луночных планшетах. 1 Готовят последовательные двукратные разведения исследуемой пробы сыворотки крови. Для этого в лунки вносят по 50,0 мкл физиологического раствора (рН 7,2). В лунку № 1 вносят 50,0 мкл исследуемой сыворотки, перемешивают и переносят 50,0 мкл в лунку № 2, перемешивают и 50,0 мкл переносят в лунку № 3 и так далее до пятой лунки. Из лунки № 5 после перемешивания удаляют 50,0 мкл разведённой сыворотки (1:32). 2 Одновременно в лунках №№ 6, 7, 8, 9 ставят следующие контроли: в лунку № 6 (контроль исследуемой сыворотки крови на наличие гемагглютининов) вносят 50,0 мкл физиологического раствора и 50,0 мкл неразведённой сыворотки крови; в лунку № 7 (контроль эритроцитарного диагностикума на самоагглютинацию) вносят 50,0 мкл физиологического раствора; в лунку № 8 (контроль активности эритроцитарного диагностикума) вносят 50,0 мкл физиологического раствора и 50,0 мкл сыворотки специфической (SS); в лунку № 9 (контроль специфичности эритроцитарного диагностикума) вносят 50,0 мкл физиологического раствора и 50,0 мкл сыворотки отрицательной (SN). 3 Вносят во все лунки (кроме лунки № 6) 50,0 мкл эритроцитарного антигенного диагностикума (ЭAS), в лунку № 6 - 50,0 мкл не сенсибилизированных эритроцитов. 4 Инкубируют 1 час при комнатной температуре. 5 Учитывают результаты РНГА по гемагглютинации 6 Определяют титр антител в исследуемой сыворотке крови За титр антител в РНГА принимают то наибольшее разведение сыворотки крови, которое ещё вызывает агглютинацию сенсибилизированных эритроцитов не менее, чем на два креста (++). Протокол определения титра антител в РНГА представлен в таблице 13. Таблица 13 Протокол определения титра антител в РНГА
Компоненты Реакции |
Разведения сыворотки Sх |
КОНТРОЛИ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1:2 | 1:4 | 1:8 | 1:16 | 1:32 | SX |
ЭА S | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 Физ.р-р (мкл) | 50,0 | 50,0 | 50,0 | 50,0 | 50,0 |
50,0 |
50,0 |
50,0 | 50,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 Исследуемая сыворотка Sх | 50,0 |
Перенос по 50,0 |
50,0 | – | – | – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3 Сыворотка специфическая SS | – | – | – | – | – | – | – |
50,0 | – | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4 Сыворотка отрицательная SN | – | – | – | – | – | – | – | – | 50,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5 ЭА S | 50,0 | 50,0 | 50,0 | 50,0 | 50,0 | – |
50,0 |
50,0 | 50,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 Эр. не сенси- билизированные | – | – | – | – | – |
50,0 | – | – | – | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6 Учёт результата | +++ | ++ | ++ | – | – | – | – | +++ | – | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Согласно результатам агглютинации сенсибилизированных эритроцитов, титр антител в сыворотке S х равен 1: 8 - большее из двух разведений сыворотки с агглютинацией на ++ (табл.13).
РНГА относится экспресс - методу, характеризуется высокой чувствительностью и специфичностью, даёт возможность проводить раннюю диагностику болезни, а также отличается простой методикой выполнения и не требует стерильных условий.
Однако следует отметить, что качество и стабильность эритроцитарных диагностикумов напрямую зависит от степени очистки антигенов, а также от индивидуально подобранных для каждого антигена вируса условий фиксации, танизации и сенсибилизации эритроцитов.
Материальное обеспечение: эритроцитарный антигенный диагностикум; исследуемая сыворотка крови; иммунологические планшеты; физиологический раствор; дистиллированная вода; механические дозаторы одноканальные с одноразовыми наконечниками; расходные материалы.
Примерный план занятия (2 часа)
1 Проведение тестирования студентов
2 Объяснение преподавателя по теме занятия.
3 Демонстрация: а) диагностического набора для РНГА; б) методики постановки РНГА.
4 Самостоятельная работа студентов: а) постановка РНГА; б) учёт результатов РНГА; в) определение титра антител в сыворотке крови..
5 Подведение итогов занятия
6 Задание к следующему занятию
Контрольные вопросы
1 В чём принцип реакции непрямой гемагглютинации?
2 В чём отличие непрямой гемагглютинации от прямой?
3 В чём заключается методика РНГА для определения титра антител в сыворотки крови?
4 В чём достоинства и недостатки РНГА?
Тема 16 Реакция торможения (задержки) гемагглютинации (РТГА)
Цель занятия: изучить реакцию торможения гемагглютинации; овладеть методикой определения титра антител в реакции торможения гемагглютинации.
Реакция торможения (задержки) гемагглютинации (РТГА, РЗГА)основана на том, что антитела при взаимодействии с гомологичными антигенами гемагглютинирующих вирусов образуют комплекс антиген – антитело, в котором вирус утрачивает не только инфекционную, но и гемагглютинирующую активность. В качестве индикатора свободного не связавшегося вируса в реакции используют эритроциты, которые получены от животного того вида, в отношении которого вирус проявляет агглютинирующую активность. Признаком положительной реакции является отсутствие (торможение или задержка) геммаггютинации.
РТГА используют, во-первых, для идентификации вируса, во-вторых – для обнаружения антител и определения титра антител.
Так как, не известно, какое количество антигена гемагглютинирующего вируса или в каком титре антитела содержатся в исследуемом материале, то перед реакцией данный материал разводят с кратностью 2. Второй стандартный специфический компонент (референс) берут в реакцию или в постоянном рабочем разведении (сыворотка), или в постоянной рабочей дозе (вирус) соответственно. Для референс–вируса таким стандартом является его гемагглютинирующий титр, равный 4 ГАЕ.
Методика определения титра антител в РТГА (табл.14)
РТГА ставят микрометодом в специальных иммунологических 96-луночных планшетах.
1 Готовят последовательные двукратные разведения исследуемой пробы сыворотки крови. Для этого вносят в лунки с № 1 по № 5 по 50,0 мкл физиологического раствора (рН 7,2), далее в лунку № 1 вносят 50,0 мкл исследуемой сыворотки, перемешивают и переносят 50,0 мкл в лунку № 2, перемешивают и 50,0 мкл переносят в лунку № 3 и так далее до пятой лунки. Удаляют из лунки № 5 после перемешивания 50,0 мкл сыворотки в разведении 1:32.
2 Добавляют к каждому разведению сыворотки по 50,0 мкл 4 ГАЕ референс–вируса.
3 Ставят одновременно следующие контроли в лунках №№ 6, 7, 8, 9, 10, 11: в лунке № 6 (контроль исследуемой сыворотки крови на наличие гемагглютининов) – вносят 50,0 мкл физиологического раствора и 50,0 мкл неразведённой сыворотки крови; в лунке № 7 (контроль эритроцитов на самоагглютинацию) – вносят 100,0 мкл физиологического раствора; в лунках № 8,9,10,11 (контроль рабочей дозы вируса – 4 ГАЕ) – вносят 50,0 мкл физиологического раствора, затем в лунку № 8 вносят 50,0 мкл вируса в титре 4 ГАЕ, перемешивают и переносят 50,0 мкл в лунку № 9, перемешивают и 50,0 мкл переносят в лунку № 10, перемешивают и переносят в лунку № 11. Из лунки № 11 после перемешивания удаляют 50,0 мкл вируса.
4 Инкубируют 30-40 мин. при комнатной температуре.
5 Вносят во все лунки по 50,0 мкл 1,0% -ной суспензии эритроцитов.
6 Инкубируют 15 – 20 мин. при комнатной температуре
7 Учитывают результат по гемагглютинации
8 Определяют титр антител в исследуемой сыворотке крови
За титр антител в РТГА принимают наибольшее разведение сыворотки, которое ещё полностью тормозит гемагглютинацию.
Таблица 14
Протокол титрования сыворотки в РТГА
| №№ лунок | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | ||||||
Компоненты
Реакции
Разведения сыворотки SХ
КОНТРОЛИ
1:2
1:4
1:8
1:16
1:32
Эр
SХ
АГ (вируса) ГАЕ
50,0
50,0
50,0
50,0
100
Перенос по 50,0
-
50,0
50,0
50,0
Перенос по 50,0
Контакт 30-40 мин. при комнатной температуре
50,0
50,0
50,0
50,0
50,0
Серологические реакции
1 В основе серологических реакций лежит взаимодействие:
+:антигена и антитела
-:антигена и вирусных белков
-:антитела и иммуноглобулинов
-:антигенов и клеток
2 Вещества, которые обладают интенсивной аутофлуоресценцией и используются для придания такого свойства не флуоресцирующим веществам, называются:
+: флуорохромы
-: конъюгат
-: фермент
-: фиксатор
3 Конъюгатами называются:
+: антитела, связанные с флуорохромом
+: антитела, связанные с ферментом
-: комплекс антиген - антитело
-: субстраты
4 Укажите полное название метода МФА:
+: метод флуоресцирующих антител
-: метод флуоресцирующих антигенов
-: метод ферментирующих антител
-: метод ферментирующих антигенов
5 Для учёта результатов в реакции иммунной флуоресценции используют:
+: люминесцентный микроскоп
-: световой микроскоп
-: электронный микроскоп
-: инвертируемый микроскоп
6 Принцип прямого варианта РИФ состоит:
+: взаимодействие антигена и специфического конъюгата
-: взаимодействие антигена и антивидового конъюгата
-: взаимодействие антигена и флуорохрома
-: взаимодействие антигена и субстрата
6 Какой конъюгат используют для непрямого варианта РИФ:
+: антивидовой флуоресцирующий
-: антивидовой пероксидазный
-: специфический флуоресцирующий
-: специфический пероксидазный
7 Какое свечение приобретает ДНК в методе флуорохромирования акридиновым оранжевым:
+: жёлто-зелёное
-: рубиново-красное
-: сине-фиолетовое
-: жёлто-коричневое
8 Укажите последовательность этапов прямого варианта РИФ:
1: приготовление мазка
2: фиксация мазка
3: нанесение конъюгата
4: контакт и отмыв от не связавшихся компонентов
5: учёт результата реакции
8 Укажите последовательность этапов непрямого варианта РИФ:
1: приготовление мазка
2: нанесение специфической сыворотки крови
3: контакт и отмыв от не связавшихся компонентов
4: нанесение антивидового конъюгата
5: контакт и отмыв от не связавшихся компонентов
6: учёт результата реакции
9 Как называется сыворотка, полученная против белков сыворотки другого вида животного:
+:антивидовая
-: специфическая антигенная
-: антивирусная
-: антикомплементная
10 Укажите полное название метода ИФА:
+: иммуноферментный анализ
-: метод флуоресцирующих антител
-: иммунофлуоресцентный анализ
-: иммунофракционный анализ
11 Конъюгатом в ИФА является:
+: антитела, связанные с ферментом
-: антитела, связанные с флуорохромом
-: комплекс антиген-антитело
-: специфический антиген
12 Что в методе ИФА лежит в основе появления цветного продукта?
+: взаимодействие фермента и субстрата
-: взаимодействие антител и антигена
-: взаимодействие фермента с антителами
-: взаимодействие субстрата с антигеном
13 Результат, полученный в ИФА можно оценить:
+: по изменению окраски визуально
+: по оптической плотности в спектрофотометре
-: по свечениюв люминесцентном микроскопе
-: по цитопатическому действию в световом микроскопе
14 Укажите последовательность этапов сэндвич варианта ИФА:
1: внесение специфических антител в лунки планшета
2: контакт и отмыв от не связавшихся компонентов
3: внесение антигена вируса в лунки планшета
4: контакт и отмыв от не связавшихся компонентов
5: внесение специфического конъюгата в лунки планшета
6: контакт и отмыв от не связавшихся компонентов
7: внесение субстрата
8: учёт результата
15 Сэндвич вариант ИФА используется для:
+: индикации и идентификации вируса
-: обнаружения антител и титрования антител
16 Укажите последовательность этапов непрямого варианта ИФА:
1: внесение специфического антигена в лунки планшета
2: контакт и отмыв от не связавшихся компонентов
3: внесение сыворотки в лунки планшета
4: контакт и отмыв от не связавшихся компонентов
5: внесение антивидового конъюгата в лунки планшета
6: контакт и отмыв от не связавшихся компонентов
7: внесение субстрата
8: учёт результата
17 Непрямой вариант ИФА используется для:
+: обнаружения и титрования антител
-: индикации и идентификации вируса
18 Метод, основанный на диффузия молекул антигенов и антител в агаровом называется _________________________________________________
+:реакция диффузионной преципитации
19 Положительным результатом РДП является:
+: наличие линий преципитации
-: наличие флуоресценции
-: наличие цветного продукта реакции
-: гибель тест-объектов
20 РДП используют для:
+: индикации и идентификации вируса
+: обнаружения антител и титрования антител
21 Реакция, в которой при образовании комплекса антиген-антитело вирус утрачивает свою инфекционную активность, называется:
+: реакция нейтрализации
-: реакция иммунной диффузии
-:иммуноферментный анализ
-:реакция диффузионной преципитации
-:реакция непрямой гемагглютинации
22 Индикатором свободного вируса в РН является:
+: живые системы
-: флуорохромы
-: ферменты
-: субстраты
23 Признак положительного ответа в РН - это:
+: отрицательный результат биопробы
-: положительный результат биопробы
-: свечение
-: окрашивание
24 Идентификацию вируса в РН проводят на основе определения:
+: индекса нейтрализации
-: гемагглютинирующей активности
-: торможения гемадсорбции
-: цитопатического действия
25 За титр антител в сыворотке крови в РН принимают:
+: разведение сыворотки, защищающее 50% - тест - объектов от 100ЭД50 вируса
-: разведение сыворотки, защищающее 50%- тест - объектов от 4ГАЕ вируса
-: разведение сыворотки, защищающее 50%- тест - объектов от гемадсорбирующей активности вируса
26 Что считается главным преимуществом реакции нейтрализации:
+: высокая специфичность
-: необходимость стерильных условий
-: быстрота постановки
-: простота реакции
27 Укажите полное название метода РНГА:
+: реакция непрямой гемагглютинации
-: реакция не полной гемагглютинации
-: реакция не пропорциональной гемагглютинации
28 Что является положительным результатом РНГА:
+: гемагглютинация
-: гемадсорбция
-: гемолиз
-: гемостаз
29 Что является обязательным компонентов в РНГА:
+: эритроциты с адсорбированными антителами
+: эритроциты с адсорбированными антигенами
-: эритроциты
-: эритроциты + стабилизатор
30 Укажите основные этапы в получение эритроцитарного диагностикума:
1: выделение эритроцитов
2: стабилизация ( консервация) эритроцитов
3: танизация эритроцитов
4: сенсибилизация эритроцитов специфическими антигенами или специфическими антителами
31 Укажите полное название метода РТГА:
+: реакция торможения гемагглютинации
-: реакция трудоёмкой гемагглютинации
-: реакция территориальной гемагглютинации
32 Как называется эффект действия, который вирус утрачивает вирус в РТГА? ________________________________________
+: гемагглютинирующий
33 Что является индикатором вируса, не связанного с антителами, в РТГА:
+: эритроциты
-: живая система
-: ферментозависимое вещество
-: агаровый гель
34 Выберите признак положительной РТГА:
+:пуговка
-:зонтик
-: линия преципитации
-:свечение
35 Как подготовить исследуемую сыворотку для ее титрования в РТГА:
+:освободить от неспецифических ингибиторов
-:исследовать в РГА
-: заморозить и отморозить
-:профильтровать
35 Чему равно стандартное значение гемагглютинирующего титра вируса, в котором его используют в РТГА:
+:4 ГАЕ
-: 3 ГАЕ
-: 2 ГАЕ
-: 1 ГАЕ
36 Что принимают в РНГА за титр антител в сыворотке:
+: наибольшее разведение сыворотки, дающее гемагглютинацию не менее, чем на два креста
-: наибольшее разведение сыворотки, тормозящее гемагглютинацию
-: наименьшее разведение сыворотки, тормозящее гемагглютинацию
-: наименьшее разведение сыворотки, дающее гемагглютинацию не менее, чем на два креста
Список литературы
1 Белоусова Р.В., Троценко Н.И., Преображенская Э.А. Практикум по ветеринарной вирусологии. – 3-е изд, перераб. и доп. – М.: КолосС, 2006. – 248 с.
2 Белоусова Р.В., Преображенская Э.А., Третьякова И.В. Ветеринарная вирусология / Под ред. проф.Р.В. Белоусовой. – КолосС, 2007. – 424 с.
3 Белоусова Р.В., Третьякова И.В., Калмыкова М.С., Ярыгина Е.И. Ветеринарная вирусология. Методические рекомендации – М.: ФГОУ ВПО МГАВМиБ, 2009. – 62 с.
4 Белоусова Р.В., Третьякова И.В., Калмыкова М.С., Ярыгина Е.И. Пособие по ветеринарной вирусологии. – М.: ФГОУ ВПО МГАВМиБ, 2013. – 62 с.
5 Белоусова Р.В.. Ярыгина Е.И., Третьякова И.В., Калмыкова М.С.., Рогожин В.Н. Вирусология и биотехнология: Учебник. – СПб.: Издательство «Лань», 2016. – 220 с.
6 Животная клетка в культуре (Методы и применение в биотехнологии) / Под ред. проф. Дьяконова Л.П., проф. Ситькова В.И. – М.: Издательство Спутник+, 2009. – 656 с.
7 Калмыкова М.С., Калмыков М.В., Белоусова Р.В. Основы полимеразной цепной реакции с разными форматами: Учебное пособие. – СПб.: Издательство «Лань», 2009. - 80 с.
8 Медицинская вирусология. часть вторая. / Под ред. А.М. Королюка и В.Б. Сбойчакова. – СПб, 2002. – 163 с.
9 Основы вирусологии: Учебное п
|
| Поделиться: |
Последнее изменение этой страницы: 2021-01-08; просмотров: 197; Нарушение авторского права страницы; Мы поможем в написании вашей работы!
infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.135.67 (0.011 с.)

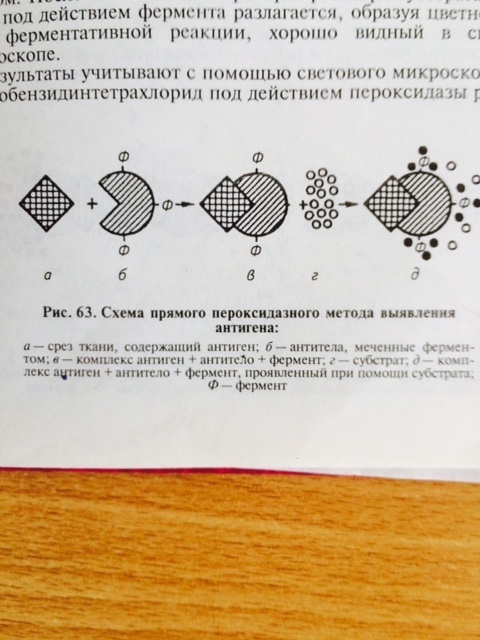 АГ АТ-ф АГ-АТ-ф субстрат цветное
окрашивание
АГ АТ-ф АГ-АТ-ф субстрат цветное
окрашивание
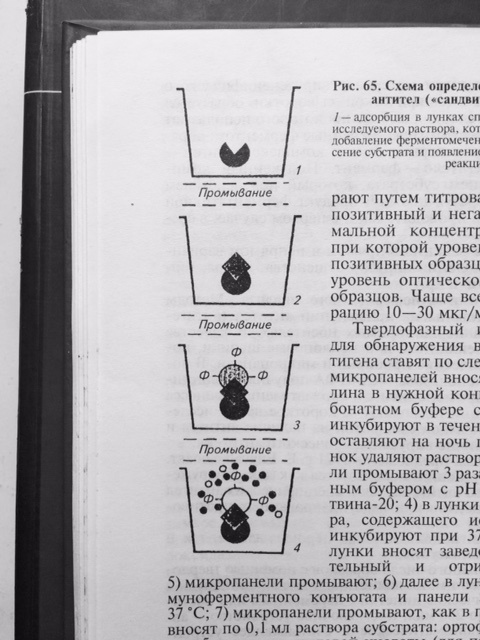
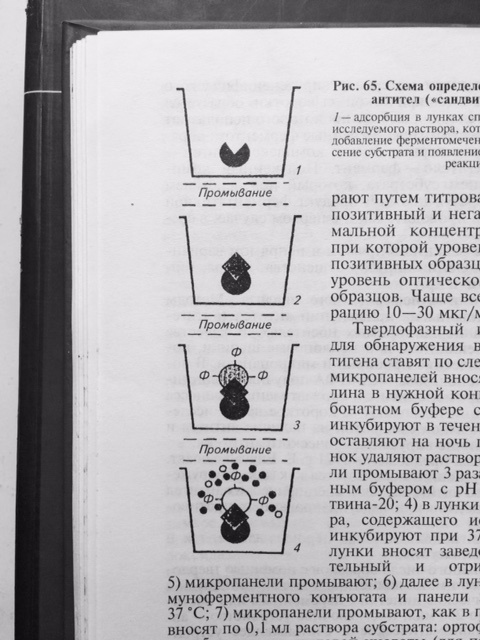
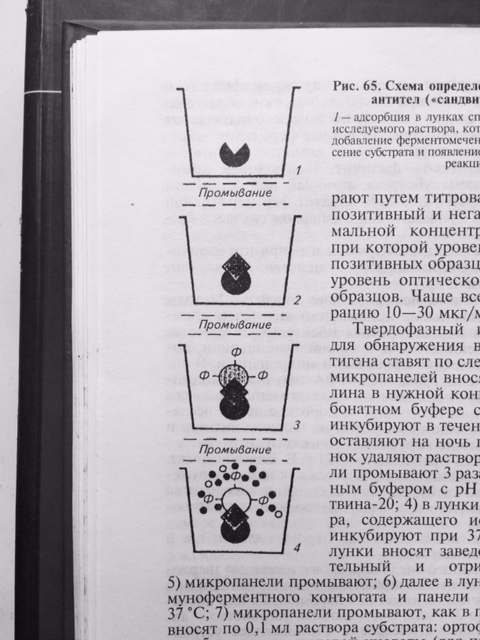
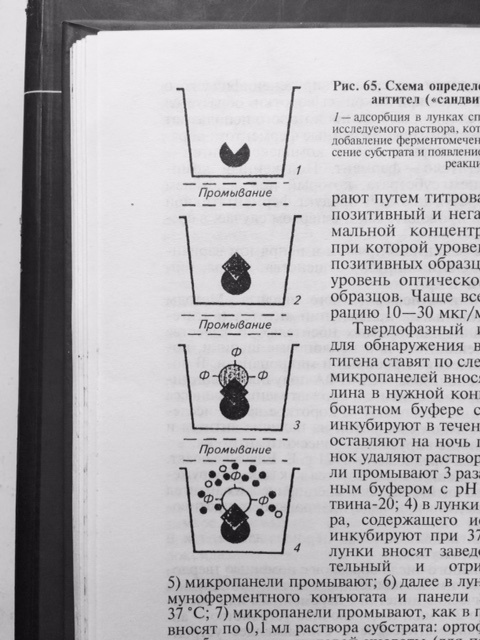 Рис. 27 Схема «сэндвич» варианта ИФА
Рис. 27 Схема «сэндвич» варианта ИФА
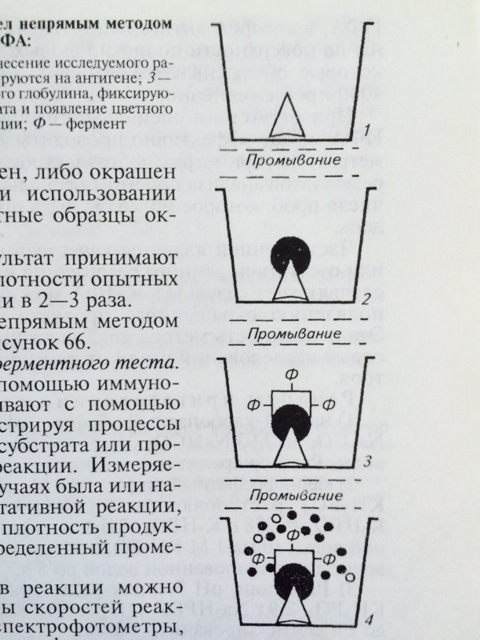
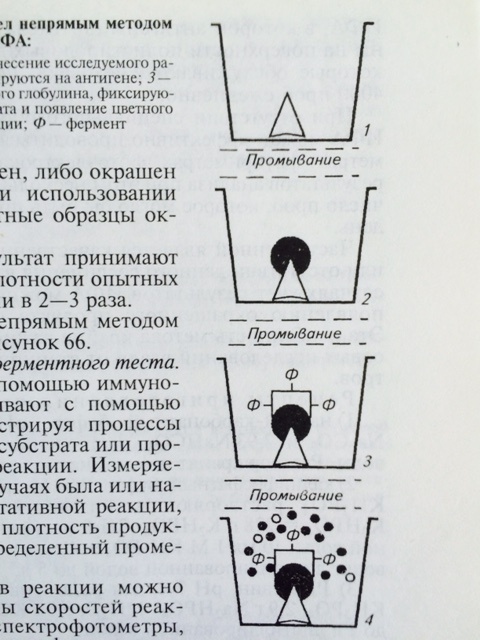
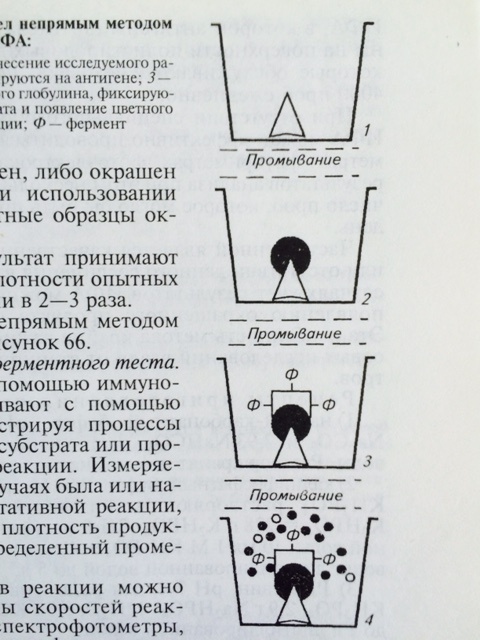
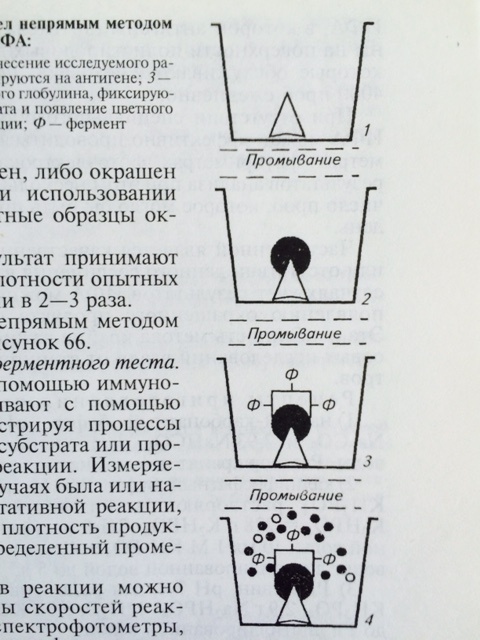 Рис. 28 Схема непрямого варианта ИФА
Рис. 28 Схема непрямого варианта ИФА