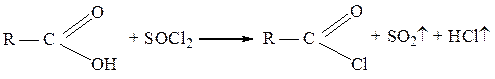Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции нуклеофильного замещения.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Одну из важнейших групп реакций, характерных для карбоновых кислот, составляют реакции нуклеофильного замещения у sp2 -гибридизованного атома углерода карбоксильной группы, в результате которых гидроксильная группа замещается на другой нуклеофил. За счет положительного мезомерного эффекта гидроксильной группы электрофильность атома углерода карбоксильной группы значительно ниже, чем у атома углерода карбонильной группы альдегидов и кетонов, поэтому реакции нуклеофильного замещения в карбоксильной группе проводятся в присутствии кислотного катализатора. Используются также иные приемы, суть которых сводится к превращению плохо уходящей группы НО─ в хорошо уходящую. В результате этих реакций образуются функциональные производные карбоновых кислот – сложные эфиры, амиды, ангидриды, галогенангидриды и др. Реакции замещения у sp2 -гибридизованного атома углерода карбоксильной группы по своему результату относительно участвующего во взаимодействии нуклеофильного реагента могут рассматриваться как реакции ацилирования, поскольку они сопровождаются введением в молекулу нуклеофильного реагента -ацильной группы R ─ CO ─. Важнейшие ацильные группы – ацетил СН3СО ─, бензоил С6Н5СО ─. Образование сложных эфиров При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а сама реакция называется реакцией этерификации:
сложный эфир
В качестве катализаторов используют концентрированную серную кислоту, газообразный хлороводород, сульфоновые кислоты, катионообменные смолы в Н+- форме. В случае сильных карбоновых кислот, таких, как щавелевая, муравьиная, трифтороуксусная, отпадает необходимость добавления минеральной кислоты, так как подобные карбоновые кислоты сами катализируют реакцию:
Реакция этерификации, как и многие другие реакции замещения у тригонального атома углерода, чаще всего протекает по тетраэдрическому механизму. На стадии катализа протонируется карбонильный атом кислорода карбоновой кислоты; гидроксильная группа не присоединяет протон, потому что неподеленная пара электронов атома кислорода находится в сопряжении с карбонильной группой. Возникший карбокатион (I) обладает значительно более сильными электрофильными свойствами, чем исходная карбоновая кислота, и поэтому может присоединять даже слабый нуклеофил, каким является молекула спирта. В образовавшемся катионе (II) происходит перенос протона к одной из гидроксильных групп, и при этом формируется хорошо уходящая группа – молекула воды. После отщепления воды от катиона (III) и возврата катализатора образуется сложный эфир.
Все стадии реакции этерификации обратимы; обратная реакция представляет собой катализируемый кислотой гидролиз сложных эфиров. При получении сложных эфиров смещение равновесия вправо достигается разными способами: удалением воды азеотропной отгонкой или с помощью осушителей, ибо с применением большого избытка спирта или кислоты, если тот или другой реактив достаточно доступен. Смещение равновесия достигается также путем отгонки образующегося сложного эфира.
Образование галогенангидридов. При взаимодействии карбоновых кислот с галогенидами фосфора(III) или фосфора (V), а также фосфорилхлоридом POCl3 образуются галогенангидриды, иначе называемые ацилгалогенидами:
Для получения хлорангидридов, особенно высококипящих, часто используют также тионилхлорид SOCl2:
Образование ангидридов. Под действием такого сильного водоотнимающего средства, как оксид фосфора (V), карбоновые кислоты превращаются в ангидриды:
Ангидриды некоторых дикарбоновых кислот образуются при нагревании их и в отсутствие водоотнимающих средств. Важно, чтобы образующийся циклический ангидрид содержал пяти- или шестичленный цикл. Такие ангидриды образуют, например, янтарная, глутаровая и фталевая кислоты.
Легко образует ангидрид двухосновная ненасыщенная малеиновая кислота (Z -изомер бутендиовой кислоты), тогда как её Е -изомер – фумаровая кислота – ангидрида вообще не имеет. Тем не менее, при нагревании фумаровая кислота также превращается в ангидрид, но в малеиновый, предварительно изомеризуясь в малеиновую кислоту:
Образование амидов. При нагревании аммониевых солей карбоновых кислот получаются амиды:
При взаимодействии карбоновых кислот с первичными или вторичными аминами образуются соответственно моно- и дизамещенные амиды:
|
||||
|
Последнее изменение этой страницы: 2019-04-27; просмотров: 758; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |