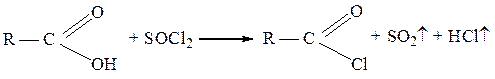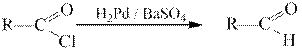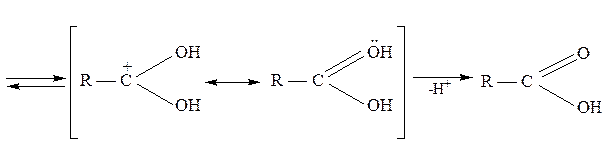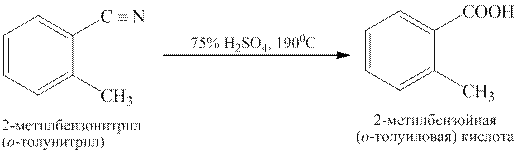Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I. Карбоновые кислоты и их производныеСодержание книги
Поиск на нашем сайте
I. Карбоновые кислоты и их производные
Изомерия и номенклатура. К классу карбоновых кислот относятся соединения, содержащие карбоксильную группу COOH. По числу карбоксильных групп в молекуле различают одноосновные и многоосновные кислоты. В зависимости от строения углеводородного радикала, связанного с карбоксильной группой, кислоты подразделяются на алифатические (насыщенные и ненасыщенные), алициклические, ароматические, гетероциклические. По систематической номенклатуре кислоты называют по соответствующим предельным углеводородам с добавлением окончания -овая кислота, причем нумерация цепи начинается от углерода карбоксильной группы. В тех случаях, когда карбоксильная группа не входит в состав углеводородной цепи, используется сочетание «карбоновая кислота», выполняющее роль суффикса. Номенклатура ИЮПАК разрешает сохранять для многих кислот их тривиальные названия, указывающие на природный источник, из которого была выделена та или иная кислота
циклопентанкарбоновая кислота
Для первого представителя ароматических кислот ИЮПАК сохранено название «бензойная кислота» (C6H5СОOH). Замещенные ароматические монокарбоновые кислоты называют, используя бензойную кислоту в качестве родоначальной структуры:
4-метилбензойная кислота 3-нитробензойная кислота
Применяют также систему, согласно которой за основу принимают тривиальное название кислоты, соответствующей самой длинной в молекуле цепи, а атомы обозначают, начиная с соседнего с карбоксильной группой, буквами греческого алфавита.
2-метилбутановая (α-метилмасляная) кислота
Изомерия предельных одноосновных карбоновых кислот аналогична изомерии монозамещенных предельных углеводородов. Кислоты с числом атомов углерода меньше четырех не имеют изомеров, а кислота с четырьмя атомами углерода имеет два изомера. Число изомеров увеличивается по мере возрастания углеродной цепи.
Физические свойства. На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. В газовой фазе и в неполярных растворителях монокарбоновые кислоты существуют в виде димеров.
Водородные связи, возникающие в карбоновых кислотах, относятся к числу самых прочных среди других водородных связей; их энергия равна 29 кДж/моль. Монокарбоновые кислоты с числом атомов углерода от 1 до 3 – бесцветные жидкости, смешиваются с водой в любых соотношениях. Кислоты, в молекуле которых содержится от 4 до 9 атомов углерода – маслянистые жидкости, растворимость их в воде невелика. Растворимость в воде высших гомологов уменьшается по мере удлинения углеродного радикала. Практически все дикарбоновые и ароматические кислоты – твердые вещества. В ряду дикарбоновых кислот наблюдаются те же закономерности: низшие гомологи лучше растворяются в воде, чем высшие. Ароматические кислоты плохо растворимы в воде.
Способы получения. Окисление альдегидов. Для окисления альдегидов используют те же реагенты, а также оксид серебра.
Окисление алкилбензолов. В качестве окислителей используют перманганат калия, соединения хрома(VI), азотную кислоту и т.д.
Гидролиз нитрилов. Нитрилы подвергаются гидролизу как в кислой, так и в щелочной среде, например:
Химические свойства. Карбоновые кислоты содержат функциональную группу СООН, связанную с радикалом или атомом водорода.
Величины валентных углов, близкие к 1200, и плоский характер карбоксильной группы указывают на sp 2-характер гибридизации углерода карбоксильной группы. В молекулах карбоновых кислот можно выделить ряд реакционных центров:
· ОН-кислотный центр, за счет которого карбоновые кислоты проявляют кислотные свойства в реакциях с основаниями; · электрофильный центр – атом углерода карбоксильной группы, при участии которого карбоновые кислоты и их функциональные производные вступают в реакции нуклеофильного замещения; · основный центр – оксогруппа со своей неподеленной парой электронов, которая протонируется на стадии катализа в реакциях нуклеофильного замещения; · СН-кислотный центр, возникающий у α-атома углерода за счет индуктивного эффекта карбоксильной группы. Кислотный характер карбоновых кислот ярко выражен. Это объясняется взаимным влиянием атомов в карбоксильной группе: в ней электронная плотность смещена в сторону наиболее электроноакцепторного атома кислорода карбонильной группы. Это приводит к ослаблению связи между кислородом и водородом в гидроксильной группе и легкости отщепления атома водорода от гидроксила в виде протона (Н+).
Появление пониженной электронной плотности (δ+) на центральном углеродном атоме карбоксила приводит также к стягиванию σ-электронов соседней связи С-С к карбоксильной группе и появлению пониженной электронной плотности δ'+ на α-углеродном атоме кислоты.
Кислотные свойства Карбоновые кислоты обладают более сильными кислотными свойствами, чем спирты и некоторые фенолы. В водных растворах они слабо диссоциированы, кислая среда обнаруживается с помощью индикаторов. При взаимодействии с основаниями, карбонатами, гидрокарбонатами и аммиаком карбоновые кислоты образуют соли:
Дикарбоновые кислоты содержат две карбоксильные группы, поэтому они образуют два ряда солей – кислые и средние.
Более сильные кислотные свойства карбоновых кислот по сравнению с другими ОН-кислотами Бренстеда (спиртами и большинством фенолов) объясняется тем, что атомы кислорода и углерод в карбоксильной группе стабилизированы за счет сопряжения. В анионе происходит полная делокализация π-электронной плотности, вследствие чего отрицательный заряд поровну распределяется между двумя атомами кислорода:
Такая делокализация электронной плотности в молекуле с энергетической точки зрения всегда более выгодна. Молекула в этом случае обладает меньшей энергией и термодинамически более устойчива. Образование таких структур является движущей силой многих реакций. Возможность выигрыша энергии при образовании симметричного аниона кислоты является причиной легкого отщепления протона от гидроксильной группы кислот, т.е. причиной проявления кислотных свойств молекулы. Симметричное строение аниона, равноценность атомов кислорода, одинаковые длины связей углерод-кислород подтверждаются данными рентгеноструктурного анализа.
Таблица №1. Значения р Ка некоторых карбоновых кислот.
Строение радикала влияет на кислотные свойства карбоновых кислот (см. табл.1). Электронодонорные заместители снижают кислотность (значение р Ка метановой кислоты на ~1 меньше, чем р Ка её гомологов). Длина и разветвленность насыщенного алкильного радикала не оказывает существенного влияния на кислотные свойства. Ненасыщенные и ароматические кислоты обладают большей кислотностью, чем насыщенные алифатические. Ароматические кислоты с заместителем в орто -положении более сильные, чем мета - и пара -изомеры. Таблица №2 .Значения р Ка замещенных алифатических карбоновых кислот.
Электроноакцепторные заместители усиливают кислотность. Из данных, представленных в табл. 2, видно, что замещенные карбоновые кислоты различаются по своей силе. Константа диссоциации трифторуксусной кислоты ~ в 50000 раз больше константы диссоциации уксусной кислоты. Все моно-, ди- и тригалогензамещенные производные уксусной кислоты превосходят уксусную кислоту по величине константы диссоциации. Влияние электроноакцепторных заместителей на кислотные свойства карбоновых кислот в алифатическом ряду подчиняется чётким закономерностям как по числу этих заместителей, так и по взаимному расположению акцепторной и карбоксильной групп (см.табл. 2). Изменение кислотности карбоновых кислот основывается на индуктивном эффекте заместителей. Заместители, обладающие отрицательным индуктивным эффектом (- Iэф), стабилизируют карбоксилат-анион, что непосредственно отражается на значении р Ка соответствующих кислот. Вследствие затухания индуктивного эффекта второй карбоксильной группы кислотные свойства дикарбоновых кислот (по первой ступени диссоциации) уменьшаются по мере удаления карбоксильных групп друг от друга (см. табл.1).
Реакции карбоновых кислот. Реакции карбоновых кислот можно подразделить на несколько групп. 1. Восстановление. 2. Реакции декарбоксилирования. 3. Реакции замещения при α-углеродном атоме. 4. Реакции нуклеофильного замещения (SN) у ацильного атома углерода.
Образование сложных эфиров При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а сама реакция называется реакцией этерификации:
сложный эфир
В качестве катализаторов используют концентрированную серную кислоту, газообразный хлороводород, сульфоновые кислоты, катионообменные смолы в Н+- форме. В случае сильных карбоновых кислот, таких, как щавелевая, муравьиная, трифтороуксусная, отпадает необходимость добавления минеральной кислоты, так как подобные карбоновые кислоты сами катализируют реакцию:
Реакция этерификации, как и многие другие реакции замещения у тригонального атома углерода, чаще всего протекает по тетраэдрическому механизму. На стадии катализа протонируется карбонильный атом кислорода карбоновой кислоты; гидроксильная группа не присоединяет протон, потому что неподеленная пара электронов атома кислорода находится в сопряжении с карбонильной группой. Возникший карбокатион (I) обладает значительно более сильными электрофильными свойствами, чем исходная карбоновая кислота, и поэтому может присоединять даже слабый нуклеофил, каким является молекула спирта. В образовавшемся катионе (II) происходит перенос протона к одной из гидроксильных групп, и при этом формируется хорошо уходящая группа – молекула воды. После отщепления воды от катиона (III) и возврата катализатора образуется сложный эфир.
Все стадии реакции этерификации обратимы; обратная реакция представляет собой катализируемый кислотой гидролиз сложных эфиров. При получении сложных эфиров смещение равновесия вправо достигается разными способами: удалением воды азеотропной отгонкой или с помощью осушителей, ибо с применением большого избытка спирта или кислоты, если тот или другой реактив достаточно доступен. Смещение равновесия достигается также путем отгонки образующегося сложного эфира.
Образование галогенангидридов. При взаимодействии карбоновых кислот с галогенидами фосфора(III) или фосфора (V), а также фосфорилхлоридом POCl3 образуются галогенангидриды, иначе называемые ацилгалогенидами:
Для получения хлорангидридов, особенно высококипящих, часто используют также тионилхлорид SOCl2:
Образование ангидридов. Под действием такого сильного водоотнимающего средства, как оксид фосфора (V), карбоновые кислоты превращаются в ангидриды:
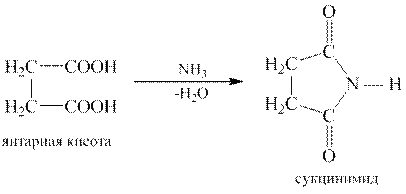
Ангидриды некоторых дикарбоновых кислот образуются при нагревании их и в отсутствие водоотнимающих средств. Важно, чтобы образующийся циклический ангидрид содержал пяти- или шестичленный цикл. Такие ангидриды образуют, например, янтарная, глутаровая и фталевая кислоты.
Легко образует ангидрид двухосновная ненасыщенная малеиновая кислота (Z -изомер бутендиовой кислоты), тогда как её Е -изомер – фумаровая кислота – ангидрида вообще не имеет. Тем не менее, при нагревании фумаровая кислота также превращается в ангидрид, но в малеиновый, предварительно изомеризуясь в малеиновую кислоту:
Образование амидов. При нагревании аммониевых солей карбоновых кислот получаются амиды:
При взаимодействии карбоновых кислот с первичными или вторичными аминами образуются соответственно моно- и дизамещенные амиды:
Номенклатура.
Номенклатура производных карбоновых кислот очень проста и исходит из названий самих карбоновых кислот. Ангидриды кислот, например, называют добавляя слово «ангидрид» к названию соответствующей кислоты.
Для названия смешанных ангидридов требуется перечислить обе кислоты, образующие ангидрид.
Для обозначения ацилгалогенидов окончание кислоты «- овая» заменяется на «- оил» с добавлением названия галогена.
Для обозначения амидов окончание «-овая», характерное для кислот, заменяется на «- амид», или окончание «карбоновая кислота» заменяется на «карбоксамид».
Замещенные при азоте амиды имеют префикс, где обозначаются эти заместители.
Название сложных эфиров строится таким образом, чтобы первую часть названия занимало обозначение алкильной группы, присоединенной к атому кислорода. Вторую часть названия составляет обозначение карбоновой кислоты, в котором окончание «- овая» заменено на окончание «- ат».
Для нитрилов существует несколько систем названий. Согласно номенклатуре ИЮПАК они называются алканнитрилами, т.е. к названию алкана добавляется окончание «- нитрил». Атом углерода нитрильной группы всегда имеет первый номер.
В другой системе названий окончание «- овая» заменяется на «- онитрил» или словосочетание «карбоновая кислота» заменяется на «- карбонитрил».
В заключении этого раздела приведем названия некоторых типичных функциональных групп производных карбоксильной группы: COOR – группа называется «алкоксикарбоксил», CONH2 – «карбамоил», COCl – «хлорформил», CN – «циано». Так называются эти группы в полифункциональнозамещенных циклоалканах и алканах.
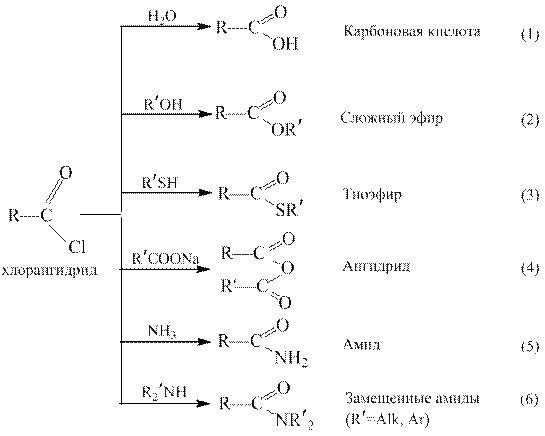
Галогенангидриды. Реакции ацилирования.
Галогенангидриды относятся к наиболее активным ацилирующим агентам, их используют для получения большинства других функциональных производных карбоновых кислот [реакции (2) – (6)]. Ацилгалогениды очень легко гидролизуются в карбоновые кислоты [реакция(1)], поэтому их хранят в условиях, исключающих доступ влаги воздуха. С помощью галогенангидридов удается проацилировать такие соединения, которые не реагируют с другими ацилирующими агентами, например, третичные спирты и фенолы.
Восстановление. Галогенангидриды восстанавливают комплексными гидридами металлов в первичные спирты:
Гидрирование галогенангидридов на палладиевом катализаторе приводит к альдегидам:
Ангидриды
Ангидридами называются функциональные производные карбоновых кислот общей формулы RC(O)OC(O)R/ Ангидриды можно рассматривать как продукты отщепления воды от карбоксильных групп двух молекул монокарбоновой кислоты или одной молекулы дикарбоновой кислоты. Существуют три основных типа ангидридов – симметричные, несимметричные, включающие остатки разных кислот, в том числе минеральных, и циклические ангидриды – производные дикарбоновых кислот:
Ангидриды представляют собой жидкости или твердые вещества, низшие ангидриды имеют раздражающий запах, похожий на запах соответствующей кислоты.
Реакции ацилирования. Реакции ацилирования протекают в условиях как кислотного, так и основного катализа или без катализатора. Ангидриды, как и галогенангидриды, способны ацилировать такие малоактивные нуклеофилы, как третичные и другие пространственно затрудненные спирты, алкилфенолы, низкоосновные ароматические амины. Из симметричных ангидридов наибольшее значение имеет уксусный ангидрид. Высокая ацилирующая способность ангидридов используется для получения большинства функциональных производных карбоновых кислот, как показано на примере уксусного ангидрида:
С помощью смешанных ангидридов в молекулу нуклеофила вводится остаток более слабой кислоты, потому что анион сильной кислоты является хорошо уходящей группой.
Сложные эфиры.
Сложными эфирами называются функциональные производные карбоновых кислот общей формулы RC(O)OR/. Сложные эфиры низших спиртов и карбоновых кислот представляют собой летучие жидкости с приятным запахом, плохо растворимые в воде и хорошо – в большинстве органических растворителей. Запахи сложных эфиров напоминают запахи разных фруктов. Повышенную летучесть сложных эфиров используют в аналитических целях. Например, для масс-спектрометрического и газожидкостного хроматографического анализа низколетучие спирты и карбоновые кислоты переводят в более летучие сложные эфиры.
Гидролиз.
Важнейшей из реакций ацилирования является гидролиз сложных эфиров с образованием спирта и карбоновой кислоты:
Реакция осуществляется как в кислой, так и в щелочной среде. Кислотно-катализируемый гидролиз сложных эфиров – реакция, обратная этерификации, протекает по тому же самому механизму, что и реакция этерификации:
Нуклеофилом в этой реакции является вода. Смещение равновесия в сторону образования спирта и кислоты обеспечивается добавлением избытка воды. Щелочной гидролиз необратим, в процессе реакции на моль эфира расходуется моль щелочи, т.е. щелочь в этой реакции выступает в качестве расходуемого реагента, а не катализатора:
Гидролиз сложных эфиров в щелочной среде протекает по бимолекулярному ацильному механизму через стадию образования тетраэдрического интермедиата (I).
Необратимость щелочного гидролиза обеспечивается практически необратимым кислотно-основным взаимодействием карбоновой кислоты (II) и алкоксид-иона (III). Образовавшийся анион карбоновой кислоты (IV) сам является довольно сильным нуклеофилом и потому не подвергается нуклеофильной атаке. Сложноэфирная конденсация.
При конденсации двух молекул сложного эфира в присутствии основного катализатора образуются эфиры β-оксокислот.
Эту реакцию рассматривают как нуклеофильное замещение у карбонильного атома углерода, т.е. как реакцию С-ацилирования.
Восстановление.
Сложные эфиры чаще восстанавливают в первичные спирты, реже в альдегиды или простые эфиры. Обычно для восстановления используют алюмогидрид лития:
Амиды.
Амидами называются функциональные производные карбоновых кислот общей формулы R─ C(O)─ NH2-n R'n, где n=0-2. В незамещенных амидах ацильный остаток соединен с незамещенной аминогруппой, а в N -замещенных амидах один из атомов водорода замещен одним алкильным или арильным радикалом, в N, N -дизамещенных – атомы водорода замещены двумя радикалами. Амиды представляют собой кристаллические вещества с относительно высокими и четкими температурами плавления, что позволяет использовать некоторые из амидов в качестве производных для идентификации карбоновых кислот.
Кислотно-основные свойства.
Амиды обладают слабыми как кислотными, так и основными свойствами. Причиной пониженной основности аминогруппы в амидах является сопряжение неподеленной пары электронов атома азота с карбонильной группой. При взаимодействии с сильными кислотами амиды протонируются по атому кислорода как в разбавленных, так и в концентрированных растворах кислот. Такого рода взаимодействие лежит в основе кислотного катализа в реакциях гидролиза амидов:
Незамещенные и N -замещенные амиды проявляют слабые NH-кислотные свойства, сравнимые с кислотностью спиртов (значения р Ка большинства амидов находятся в пределах 15,1-19,0) и отщепляют протон только в реакциях с сильными основаниями. Кислотно-основное взаимодействие лежит в основе образования амидами межмолекулярных ассоциатов, существованием которых объясняются высокие температуры плавления и кипения амидов. Возможно существование двух типов ассоциатов: линейных полимеров и циклических димеров.
Реакции ацилирования.
Вследствие наличия в сопряженной системе амидов сильной электронодонорной аминогруппы электрофильность карбонильного атома углерода, а следовательно, и реакционная способность амидов в реакциях ацилирования очень низкая. Низкая ацилирующая способность амидов объясняется также и тем, что амид-ион NH2- - плохо уходящая группа. Из числа реакций ацилирования практическое значение имеет гидролиз амидов, который можно проводить в кислой и щелочной средах. Амиды гидролизуются намного труднее, чем другие функциональные производные карбоновых кислот. Гидролиз амидов проводится в более жестких условиях по сравнению с гидролизом сложных эфиров. Кислотный гидролиз амидов – необратимая реакция, приводящая к образованию карбоновой кислоты и аммониевой соли:
В большинстве случаев кислотный гидролиз амидов протекает по механизму бимолекулярного кислотного ацилирования, т.е. во многом похож на механизм кислотного гидролиза сложных эфиров. Необратимость реакции обусловлена тем, что аммиак или амин в кислой среде превращаются в ион аммония, не обладающий нуклеофильными свойствами. Щелочной гидролиз тоже необратимая реакция; в результате её образуется соль карбоновой кислоты и аммиак или амин:
Щелочной гидролиз амидов, как и гидролиз сложных эфиров, протекает по тетраэдрическому механизму.
Дегидратация.
Незамещенные амиды под действием оксида фосфора (V) и некоторых других реагентов (POCl3, PCl5, SOCl2) превращаются в нитрилы:
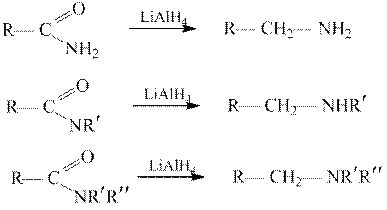
Восстановление. Амиды восстанавливаются значительно труднее альдегидов и кетонов, сложных эфиров, нитросоединений. В зависимости от применяемого реагента амиды могут быть восстановлены в амины (без разрыва связей C─ N) или в альдегиды (с разрывом связи C─ N). При действии алюмогидрида лития амиды восстанавливаются в первичные, вторичные и третичные амины:
Восстановление N -замещенных амидов натрием в жидком аммиаке в присутствии спирта позволяет получать с хорошими выходами альдегиды:
Ацилирование амидов.
При нагревании незамещенных или N -монозамещенных амидов с ангидридами или галогенангидридами образуются имиды, т.е. диацильные производные аммиака. В реакциях этого типа амиды выступают в роли слабого нуклеофильного реагента. Будучи амбидентными нуклеофилами, амиды могут ацилироваться как по атому кислорода, так и по атому азота. Полагают, что вначале быстро образуется кинетически контролируемый продукт О -ацилирования, который затем перегруппировывается в более устойчивый термодинамически контролируемый продукт N -ацилирования (имид):
Из дикарбоновых кислот или их ангидридов получают циклические имиды. Легче образуются имиды с пятичленным циклом:
Алкилирование.
Алкилирование амидов, как и ацилирование, можно осуществить по атомам азота и кислорода:
Продукты N -алкилирования термодинамически более устойчивы по сравнению с продуктами О -алкилирования, которые называются иминоэфирами или имидатами. Галогенирование.
Атом водорода в аминогруппе первичных и вторичных амидов замещается на галоген при действии галогенов или гипогалогенитов:
Галогенирование амидов в избытке щелочи сопровождается расщеплением амидов (расщепление по Гофману) и приводит к образованию первичных аминов, имеющих в молекуле на один атом углерода меньше, чем в исходном амиде:
Нитрилы. Нитрилами (цианидами) называются соединения общей формулы R─ C ≡ N Нитрилы отличаются по строению от ацильных производных, и к группе функциональных производных карбоновых кислот их относят из тех соображений, что они гидролизуются с образованием карбоновых кислот или амидов.
Гидролиз. Нитрилы относятся к очень слабым ацилирующим агентам, более слабым, чем даже амиды, поэтому они гидролизуются (в кислой или щелочной среде) значительно труднее ацильных производных:
Неполный гидролиз нитрилов, приводящий к амидам, удобно проводить в щелочной среде в присутствии пероксида водорода:
Восстановление. Нитрилы могут быть восстановлены в первичные амины разными методами – каталитическим гидрированием, натрием в этаноле, алюмогидридом лития, например:
По сравнению с другими функциональными производными карбоновых кислот нитрилы восстанавливаются значительно труднее.
Ответ: 4.
2. Наиболее сильной кислотой является:
Решение: Строение радикала влияет на кислотные свойства карбоновых кислот. Электроноакцепторные заместители усиливают кислотность, а электронодонорные – снижают. Следовательно наиболее сильной кислотой является трихлоруксусная (Cl3CCOOH).
Ответ: 5.
3. Насыщенными дикарбоновыми кислотами являются:
1. терефталевая, фумаровая, лимонная; 2. винилуксусная, кротоновая, акриловая; 3. малоновая, янтарная, глутаровая; 4. изовалериановая, масляная, уксусная; 5. фенилуксусная, бензойная, фталевая.
Решение: Насыщенные дикарбоновые кислоты содержат две карбоксильные группы, связанные с углеводородным радикалом, в котором все атомы углерода находятся в состоянии s p 3-гибридизации. Следовательно это - малоновая (HOOCCH2COOH), янтарная (HOOCCH2CH2COOH), глутаровая (HOOCCH2CH2CH2COOH) кислоты.
Ответ: 3.
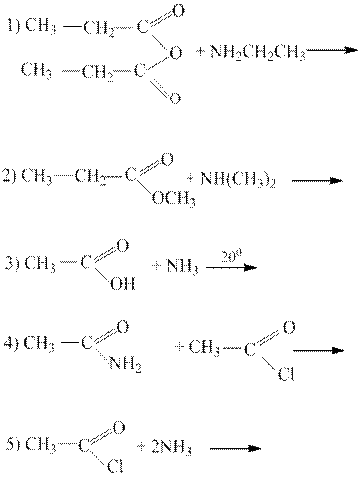
4. Этанамид образуется в результате реакции:
Решение: Методом получения амидов является ацилирование аммиака и аминов галогенангидридами, ангидридами и сложными эфирами.
Ответ: 5.
5. Реакцией этерификации является:
Решение: При взаимодействии карбоновых кислот со спиртами в присутствии кислотных катализаторов образуются сложные эфиры, а реакция называется – этерификацией:
Ответ: 2.
Установите соответствие.
Решение: Этилбутаноат, бутилацетат, этилацетат – сложные эфиры низших спиртов и карбоновых кислот, образованные соответственно этиловым спиртом и бутановой кислотой, бутиловым спиртом и уксусной кислотой, этиловым спиртом и уксусной кислотой.
Ответ: 1-Д; 2-А; 3-Г.
7. Установите соответствие.
|
|
Последнее изменение этой страницы: 2019-04-27; просмотров: 346; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.223.240 (0.014 с.) |