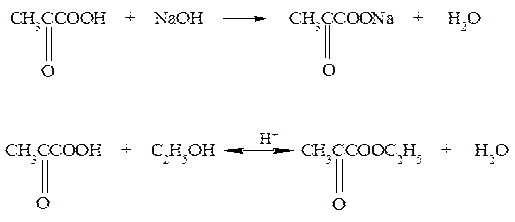Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическое окисление гидрокси- и оксокарбоновых кислот.⇐ ПредыдущаяСтр 12 из 12
Реакции цикла Кребса. Цикл трикарбоновых кислот впервые был открыт английским биохимиком Г.Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбоновых кислот является тем центром, в котором сходятся практически все метаболические пути. Таким образом цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль «клеточного топлива» углеводов, жирных кислот и аминокислот. Цикл Кребса также называют циклом лимонной кислоты или циклом ди- и трикарбоновых кислот. Участвующие в цикле ди- и трикарбоновые кислоты находятся в виде анионов, поэтому все реакции цикла Кребса даны для анионных форм. Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл состоит из восьми последовательных стадий. I стадия является реакцией нуклеофильного присоединения (АN) ацетилкофермента А по двойной связи карбонильной группы оксалоацетата. Образующийся цитрилкофермент А легко гидролизуется до цитрата (аниона лимонной кислоты) и кофермента А:
II стадия заключается в изомеризации цитрата в изоцитрат, которая осуществляется за счет двух последовательных реакций: дегидратации исходного цитрата и гидратации образующегося промежуточного продукта:
IIIа стадия – дегидрирование (окисление) изоцитрата дегидрогеназой с окисленной формой кофермента НАД+ с образованием оксалосукцината:
IIIб стадия – декарбоксилирование оксалоацетата в 2 оксоглутарат в результате внутримолекулярной дисмутации:
IV стадия является реакцией окислителного декарбоксилирования, происходящей под действием двух коферментов: НАД+ (окислитель) и HSКоА – и сопровождаемой межмолекулярной дисмутацией. На этом заканчивается этап окисления ацетильного остатка ацетилкофермета до СО2 и Н2О:
V стадия заключается в гидролизе сукцинилкофермента А. Это – экзэргоническая реакция, с которой сопряжен синтез одной молекулы АТФ:
VI стадия является реакцией дегидрирования сукцината в фумарат дегидрогеназой с окисленной формой кофермента ФАД, сопровождаемой межмолекулярной дисмутацией:
VII стадия заключается в стереоспецифическом присоединении молекулы воды по кратной межуглеродной связи с образованием исключительно L-малата (аниона L-оксоянтарной кислоты). Эта реакция сопровождается внутримолекулярной дисмутацией:
VIII стадия, сопровождаемая межмолекулярной дисмутацией, приводит к регенерации оксалоацетата за счет дегидрирования L-малата дегидрогеназой и окисленной формой кофермента НАД:
Образовавшийся оксалоацетат опять вступает в реакцию (I стадия) с новой молекулой ацетилкофермента А. Таким образом, из 11 реакций цикла Кребса девять сопровождаются окислительно-восстановительной дисмутаций за счет углеродных атомов, причем пять имеет межмолекулярный, а четыре – внутримолекулярный характер. Как видно, за один оборот цикла, состоящего из восьми стадий, происходит полное окисление одной молекулы ацетил-КоА. В результате реакций одного цикла Кребса образуется 12 молекул АТФ, из них одна молекула синтезируется в результате экзэргонической реакции стадии V, а остальные – за счет окисления образующихся трех молекул НАД(Н) и одной молекулы ФАД(2Н), которое протекает в электронотранспортной цепи. Всего за счет полного окисления одной молекулы стеариновой кислоты С17Н35СООН, включая реакции её β-окисления и цикла Кребса, в митохондрии синтезируется 146 молекул АТФ, а пальмитиновой кислоты С15Н31СООН – 129 молекул АТФ. Кратко схема превращения ацетил-КоА и оксалоацетата в цикле Кребса представлена на рисунке.
Работа ферментов цикла Кребса очень надежна, так как не известны патологические состояния, связанные с недостатком активности какого-либо из этих ферментов. Это указывает на важность реакций цикла Кребса для организма и хорошую их защищенность от внешних воздействий.
Эталонное решение задач.
1. Предложите схему синтеза молочной кислоты из 2-хлорпропановой кислоты. Обладает ли полученная кислота оптической активностью? Какой продукт образуется при нагревании молочной кислоты? Напишите схему реакции.
Решение: Гидроксикислоты получают из галогенкарбоновых кислот в результате обработки их щелочью с последующим взаимодействием образующейся соли гидроксикислоты с кислотой:
Благодаря наличию в молекуле асимметрического атома углерода она может существовать в виде двух оптически активных энантиомеров:
Так как молочная кислота относится к α-гидроксикислотам, то она при нагревании образует устойчивый шестичленный циклический диэфир-лактид:
2. Какое соединение образуется при нагревании 3-гидроксибутановой кислоты? Объясните, почему при нагревании этой кислоты невозможна внутри- и межмолекулярная этерификация? Решение: 3-гидроксибутановая кислота относится к β-гидроксикислотам, а этим кислотам при нагревании или под действием минеральных кислот характерны реакции дегидратации с образованием α,β-ненасыщенных кислот:
Внутри- или межмолекулярная этерификация в этом случае невозможна, так как она привела бы к образованию неустойчивого четырех- или восьмичленного цикла (лактона и лактида соответственно). Направленность реакции определяется большей подвижностью атома водорода в α-положении по сравнению с γ-положением.
3. Напишите схему реакций взаимодействия β-гидроксикислоты с гидроксидом натрия, этанолом и аммиаком. Назовите продукты реакции. Решение: Наличие в молекуле гидроксикислот карбоксильной и гидроксильной групп приводит к тому, что эти соединения вступают в реакции, свойственные как спиртам, так и кислотам. С гидроксидом натрия, этанолом и аммиаком реакции идут по карбоксильной группе:
4. Приведите схемы реакций взаимодействия молочной (2-гидроксипропановой) кислоты с галогеноводородом и уксусным ангидридом. Решение: Вступление в реакцию спиртового и кислотного гидроксила определяется выбором реагента и условиями реакции. С галогенводородом и уксусным ангидридом в реакции участвует спиртовой гидроксил:
5. Напишите схему реакций взаимодействия α-гидрокислоты с натрием и пентахлоридом фосфора. Решение: При взаимодействии щелочных металлов с гидроксикислотами сначала получаются соли, а затем алкоголяты:
При действии пентахлорида фосфора замещается галогеном спиртовой и кислотный гидроксил:
6. Напишите схему расщепления лимонной кислоты под действием концентрированной серной кислоты. Какое карбонильное соединение получается в результате? Напишите схему соответствующей реакции. Решение: Нагревание с серной кислотой приводит к расщеплению лимонной кислоты на ацетондикарбоновую и муравьиную кислоты, которые распадаются далее с выделением соответственно диоксида и монооксида углерода: Процесс распада ацетондикарбоновой кислоты приводит к образованию ацетона
7. Напишите схемы реакций взаимодействия пировиноградной (2-оксопропановой) кислоты с гидроксидом натрия, этанолом и аммиаком. Решение: Наличие в молекуле пировиноградной кислоты карбонильной и карбоксильной групп приводит к тому, что в зависимости от реагента и условий реакции, процесс может протекать как по оксо-, так и по карбоксильной группе.
С гидроксидом натрия и этанолом реакция протекает по карбоксильной группе:
С аммиаком реакция протекает одновременно по карбонильной и карбоксильной группам:
8. Приведите схемы реакций взаимодействия ацетоуксусной (3-оксобутановой) кислоты с гидроксиламином и циановодородной кислотой. Решение: Оксокислоты с гидроксиламином и циановодородной кислотой образуют производные по карбонильной группе. Оксогруппе характерны реакции присоединения:
9. Пировиноградная (2-оксопропановая) кислота при добавлении кислот вступает в реакцию альдольной конденсации, а образующийся альдоль легко превращается в лактон. Напишите схемы реакций. Решение: Некоторые α-оксокислоты из-за наличия в молекуле СН-кислотного центра вступают в реакции альдольной конденсации. Пировиноградная кислота при длительном стоянии, а ещё быстрее при добавлении кислот, превращается в соответствующий альдоль, который затем отщепляет воду, образуя лактон:
10. Напишите схемы реакций ацетоуксусного эфира с металлическим натрием, бромом, синильной кислотой, фенилгидразином. Решение: Ацетоуксусный эфир – пример соединения, способного к кето-енольной таутомерии. Обе формы эфира могут быть получены в свободном состоянии: кетонная – вымораживанием, енольная – перегонкой в кварцевой посуде. В химических превращениях ацетоуксусный эфир в зависимости от реагента ведет себя как кетон или как енол. Реакции отвечающие кетонной форме: 1) присоединение синильной кислоты:
2) действие фенилгидразина: продукт реакции теряет молекулу спирта и образует метилпиразолон:
Реакции, отвечающие енольной форме: 1) образование натрийацетоуксусного эфира:
2) присоединение брома:
Эту реакцию используют для количественного определения содержания енольной формы в равновесной смеси.
3) действие пентахлорида фосфора:
6. Задачи для самостоятельного решения.
1. Напишите схемы реакций образования гидротартрата и тартрата калия. Какой структурный фрагмент можно обнаружить с помощью этих реакций?
2. Какой структурный фрагмент в молекуле винной кислоты может образовывать комплексную соль меди (II)?
3. Какой химический процесс происходит при нагревании молочной кислоты с концентрированной серной кислотой? Напишите схему реакции.
4. Напишите схемы реакций, происходящих при взаимодействии 2-этилацетоуксусного эфира с разбавленным раствором гидроксида калия и 2,2-диметилацетоуксусного эфира с концентрированным раствором гидроксида калия.
5. Напишите схему таутомерных превращений ацетоуксусного эфира, происходящих при комнатной температуре.
6. Какой структурный фрагмент молекулы ацетоуксусного эфира обуславливает появление вишневого окрашивания с хлоридом железа(III)?
7. Какие факторы способствуют стабилизации енольной формы ацетоуксусного эфира?
8. Какая реакция служит для количественного определения содержания енольной формы в растворах β-оксокислот?
9. Напишите схему гидролиза ацетилсалициловой кислоты при нагревании её водного раствора. Какой структурный фрагмент в молекуле кислоты даёт фиолетовое окрашивание с хлоридом железа(III)?
10. В состав кетоновых тел входит β-гидроксимаслянная кислота. Напишите схему реакции, происходящей при нагревании этого соединения.
11. Напишите схему реакции декарбоксилирования ацетоуксусной (3-оксобутановой) кислоты. Назовите продукт реакции.
12. На одной из стадий цикла Кребса происходит взаимное превращение лимонной, изолимонной и цис -аконитовой кислот. Какая и них может существовать в виде энантиомеров? Напишите проекционные формулы этих энантиомеров.
13. Приведите проекционные формулы Фишера винной (2,3-дигидроксибутановой) кислоты.
14. Напишите реакции, протекающие при нагревании пировиноградной кислоты с разбавленной и концентрированной серной кислотой. Назовите продукты реакции.
15. Глиоксалевая (2-оксопропановая) кислота в отличии от алифатических альдегидов образует устойчивую гидратную форму. Приведите строение этой гидратной формы и объясните причину её устойчивости.
Литература 1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. М.; Медицина, 1991. 2. «Руководство к лабораторным занятиям по органической химии» под редакцией Тюкавкиной Н.А. Дрофа. М. 2003. 3. «Органическая химия» под редакцией Тюкавкиной Н.А. Дрофа. М. 2003. 4. Слесарев В.Н. Основы химии живого. ХИМИЗДАТ. Санкт-Петербург. 2000. 5. Грандберг И.И. Органическая химия. Академкнига. М. 2008. 6. Травень В.Ф. Органическая химия. Академкнига. М. 2008. 7. Мари Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. Мир-. М. 1993.
Содержание I. Карбоновые кислоты и их производные. 3 1. Изомерия и номенклатура. 3 2. Физические свойства. 4 3. Способы получения. 5 3.1. Окисление первичных спиртов. 5 3.2. Окисление альдегидов. 5 3.4. Окисление алкилбензолов. 6 3.5. Галоформная реакция метилкетонов. 6 3.6. Гидролиз нитрилов. 6 3.7. Гидролиз функциональных производных карбоновых кислот (ацилгалогенидов, ангидридов, сложных эфиров, амидов и т.д.). 6 3.8. Гидролиз тригалогенопроизводных. 7 4. Химические свойства. 7
4.1. Кислотные свойства. 8 4.2. Реакции карбоновых кислот. 12 4.2.1. Восстановление карбоновых кислот. 12 4.2.2. Реакции декарбоксилирования. 12 4.2.3. Галагенирование алифатических карбоновых кислот. 14 4.2.4. Реакции нуклеофильного замещения. 14 4.2.5. Образование сложных эфиров. 15 4.2.6. Образование галогенангидридов. 17 4.2.7. Образование ангидридов. 17 4.2.8. Образование амидов. 19 5. Отдельные представители карбоновых кислот. 19 6. Функциональные производные карбоновых кислот. 22 6.1. Номенклатура. 22 6.2. Химические свойства производных карбоновых кислот. 25 6.3. Галогенангидриды. 27 6.3.1. Реакции ацилирования. 27 6.3.2. Восстановление. 28 6.4. Ангидриды.. 29 6.4.1.Реакции ацилирования. 29 6.5. Сложные эфиры. 30 6.5.1. Гидролиз. 31 6.5.2. Сложноэфирная конденсация. 32 6.5.3. Восстановление. 33 6.6. Амиды. 33 6.6.1. Кислотно-основные свойства. 34 6.6.2. Реакции ацилирования. 34 6.6.3. Расщепление азотистой кислотой. 35 6.6.4. Дегидратация. 36 6.6.5. Восстановление. 36 6.6.6. Ацилирование амидов. 37 6.6.7. Алкилирование. 38 6.6.8. Галогенирование. 38 6.7. Нитрилы. 39 6.7.1. Гидролиз. 39 6.7.2. Восстановление. 40 6.8. Взаимные превращения производных карбоновых кислот. 40 7. Медико-биологическое значение карбоновых кислот и их производных. 41 8. Эталонное решение тестовых задач. 44 9. Задачи для самостоятельного решения. 50 II. Гидроксикислоты. 52 1. Общая характеристика. 52 1.1. Некоторые биогенные гидроксикарбоновые кислоты.. 53 2. Способы получения. 58 2.1. Гидролиз галогенозамещённых карбоновых кислот. 58 2.2. Омыление гидроксинитрилов. 58 2.3. Реакция Реформаторского. 59 2.4. Гидратация непредельных карбоновых кислот. 59 2.5. Окисление гидроксиальдегидов и гликалей. 60 3. Физические и химические свойства. 61 3.1. Восстановление α-гидроксикислот. 62 3.2. Нагревание α-гидроксикислот. 62 3.3. Реакция дегидротации α-, β- и γ-гидроксикислот. 62 3.3.1. Образование лактидов. 62 3.3.2. Образование непредельных кислот. 63 3.3.3. Образование лактонов. 63 4. Отдельные представители. 64 III. Оксокислоты. 67 1. Общая характеристика. 67 1.1. Некоторые биогенные оксокарбоновые кислоты.. 67 и их биологическая роль. 67 2. Способы получения. 69 2.1. Гидролиз дигалогенозамещённых кислот. 69 2.2. Гидролиз α-оксонитрилов. 69 2.3. Сложноэфирная конденсация. 69 2.4 Дегидратация и декарбонилирование лимонной кислоты.. 70 2.5 Синтез γ-оксокислот из янтарного ангидрида. 70 3. Химические свойства. 71 3.1. Образование гидратных форм. 72 3.2. Декарбоксилирование и декарбонилирование α-оксо-кислот. 72 3.3.Кето-енольная таутомерия, β-оксокислот и их сложных эфиров.. 72 3.3.1. Химические свойства таутомерных форм. 75 3.3.2. Кетонное и кислотное расщепление. 76 3.3.3. Декарбоксилирование. 77 3.4. γ- и δ-Оксокислоты.. 78 4.Биологическое окисление гидрокси- и оксокарбоновых кислот. 78 Реакции цикла Кребса. 78 5.Эталонное решение задач. 85 6. Задачи для самостоятельного решения. 93 Литература. 95 Содержание. 96
|
|||||||||
|
Последнее изменение этой страницы: 2019-04-27; просмотров: 579; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.141.96 (0.103 с.) |









 Схема превращений в цикле Кребса.
Схема превращений в цикле Кребса.