Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Второе начало термодинамики. Формулировка. Обратимые и необратимые в термодинамическом смысле процессы. Энтропия как критерий возможности протекания самопроизвольных процессов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Второе начало термодинамики: В изобарно-изотермических условиях (р, Т = const) в системе самопроизвольно могут протекать только такие процессы, в результате которых энергия Гиббса системы уменьшается (ΔG < 0). В состоянии равновесия G = const, G = 0
Обратимый процесс (то есть равновесный) — термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений. Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину. Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы.
Энтропия – энтропия – функция состояния, приращение которой ΔS равно теплоте Qмин подведённой к системе в обратимом изотермическом процессе, делённой на абсолютную температуру T, три которой осуществляется процесс: ΔS = Qмин/ T или мера вероятности пребывания системы в данном состоянии – мера неупорядоченности системы.
7. Энергия Гиббса – главный критерий возможности протекания самопроизвольных процессов. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов.
Критериями направления самопроизвольного протекания необратимых процессов являются неравенства ΔG < 0 (для закрытых систем), ΔS > 0 (для изолированных систем). Если величина ΔG имеет отрицательный знак (ΔG < 0), то реакция самопроизвольно может протекать только в прямом направлении. Причем абсолютное значение разности ΔH – TΔS = ΔG будет определять движущую силу данного процесса. Если же ΔG > 0, то в условиях, для которых были измерены ΔH и TΔS, в прямом направлении данная реакция протекать не может. Зато осуществимой окажется обратная реакция, для которой ΔG будет иметь отрицательное значение. Реакции, для которых ΔH < 0, а ΔS > 0, могут самопроизвольно протекать в прямом направлении при любых температурах, т.к. ΔG у них всегда будет меньше нуля. Примером такой реакции может служить гидролиз пептидов или белков. Если для химической реакции ΔH > 0, а ΔS < 0, то ее самопроизвольное протекание в прямом направлении всегда неосуществимо, т.к. энергия Гиббса в данном случае возрастает. Примером такой реакции может служить процесс фотосинтеза – образование глюкозы и кислорода из углекислого газа и воды, – который невозможен без участия солнечной энергии. В случае ΔH > 0 и ΔS > 0 самопроизвольному протеканию реакции в прямом направлении способствует энтропийный фактор. При низких температурах отрицательное значение ΔH – TΔS может быть невозможно, но при нагревании – оно возможно и реакция становится осуществимой в прямом направлении. Например, тепловая денатурация белковых молекул. Если ΔH < 0 и ΔS < 0, то отрицательное значение ΔG такой химической реакции наблюдается только при достаточно низких температурах. При вычислении ΔG в химической реакции можно использовать следствие из закона Гесса, применяемое для расчета ее теплового эффекта (изменения энтальпии). В данном случае оно будет звучать следующим образом.
В ходе самопроизвольного процесса в закрытых системах G уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG= 0). Самопроизвольное течение реакций в закрытых системах контролируется как энтальпийным (ΔrH ), так и энтропийным (TΔrS) фактором. Для реакций, у которых ΔrH< 0 иΔrS> 0, энергия Гиббса всегда будет убывать, т.е.ΔrG< 0, и такие реакции могут протекать самопроизвольно при любых температурах В изолированных системах энтропия приобретает максимально возможное для данной системы значение Smax; в состоянии равновесияΔS= 0 Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю. В самопроизвольной реакции: ∆G<0 (G2-G1<0) ∆S>0 (S2-S1>0) реакция пойдет → ∆G>0 ∆S<0 реакция пойдет ← Формула для I и II т/д: ∆Gт=∆H0хр - Т∆S Энтальпийный и энтропийный факторы Из приведенного выражения следует, что самопроизвольное течение реакции может контролироваться как энтальпийным (∆H), так и энтропийным фактором (T∆S). Очевидно, что для реакций, характеризующихся ∆Hr< 0 и ∆Sr> О, энергия Гиббса должна обязательно убывать, т. е. ∆Gr< 0, и такие реакции могут протекать самопроизвольно при любых температурах, так как оба фактора способствуют протеканию процесса. Пример такой реакции — гидролиз белка. Наоборот, при ∆Hr> 0 и ∆Sr< 0 самопроизвольное течение реакций всегда невозможно, так как энергия Гиббса должна обязательно возрастать. Оба фактора препятствуют протеканию реакции. Пример — фотосинтез, т. е. образование глюкозы и кислорода из углекислого газа и воды. Несогласованное действие факторов наблюдается в двух случаях: 1) ∆Hr> 0 и ∆Sr> 0 — самопроизвольному протеканию реакции способствует энтропийный фактор, отрицательное значение изменения энергии Гиббса возможно при соотношении |∆Sr |> |∆Hr|, т. е. при достаточно высоких температурах. Примером процессов этого типа является тепловая денатурация белков; 2) ∆Hr< О и ∆Sr< О — благоприятствующим фактором является энтальпийный, соотношение AGT< 0 наблюдается при |∆Hr| >|∆Sr |, т. е. при достаточно низких температурах. Пример процессов этого типа — гидратация белков. 8. Термодинамические условия равновесия. Стандартная энергия Гиббса образования вещества, стандартная энергия Гиббса биологического окисления вещества. Стандартная энергия Гиббса реакции. Примеры экзергонических и эндергонических процессов, протекающих в организме. Принцип энергетического сопряжения.
Под стандартной энергией Гиббса биологического окисления ΔG°, понимают изменение энергии Гиббса при реакции биологического окисления 1 моль вещества, находящегося в стандартном состоянии.Под стандартной энергией Гиббса образования ΔG°, понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии
Принцип энергетического сопряжения: Сопряженные реакции – это реакции, в которых протекание одной реакции обусловлено протеканием другой, невозможной в отсутствии первой. Принцип энергетического сопряжения заключается в том, что энергия необходимая для протекания эндергонической реакции поступает за счет осуществление экзэргонической реакции, причем в двух реакциях присутствует общее веществ- интермедиан. 9. Химическое равновесие. Обратимые и необратимые по направлению реакции. Термодинамические условия равновесия в изолированных и закрытых системах. Константа химического равновесия.
Химическая кинетика изучает скорости химических реакций, их зависимость от различных факторов и механизмы реакций. Последовательность и характер стадий химических реакций называют механизмом реакции.
Факторы влияющие на протекание реакции В организме человека протекают тысячи ферментативных реакций, проходящих в живой клетке. Однако в многостадийной цепи процессов достаточно велика разница между скоростями отдельных реакций. Так, синтезу в клетке молекул белка предшествует, по крайней мере, еще две стадии: синтез транспортной РНК и синтез рибосом. Но время, за которое удваивается концентрация молекул т-РНК, составляет 1,7 мин., молекулы белка - 17 мин., а рибосом - 170 мин. Скорость суммарного процесса медленной (лимитирующей) стадии, в нашем примере - скорость синтеза рибосом. Наличие лимитирующей реакции обеспечивает высокую надежность и гибкость управления тысячами реакций, происходящих в клетке. Достаточно держать под наблюдением и регулировать лишь наиболее медленные из них. Такой способ регулирования скорости многостадийного синтеза носит название принципа минимума. Он позволяет существенно упростить и сделать более надежной систему авторегулирования в клетке.
Скорость реакций в зависимости от молекулярности будет выражаться уравнениями: а) V = к • СА - для мономолекулярной реакции; б) V = к • СА • Св или в) V = к • С2А - для бимолекулярной реакции; г) V = к • С • Св • С э д) V = к • С2А • Св или е) V = k • С3А- для тримолекулярной реакции. Классификации реакций, применяющиеся в кинетике: реакции, гомогенные, гетерогенные и микрогетерогенные; реакции простые и сложные (параллельные, последовательные, сопряженные, цепные). Молекулярность элементарного акта реакции. Кинетические уравнения. Порядок реакции. Период полупревращения
Молекулярность реакции – это количество молекул, которые принимают участие единовременно в одном акте столкновений. Молекулярность можно определить, лишь установив механизм реакции. В зависимости от числа реагирующих молекул (частиц), участвующих в элементарном акте, различают одномолекулярные (мономолекулярные), двухмолекулярные, тримолекулярные реакции. К одномолекулярным реакциям типа А→Р относятся процессы распада молекулы на более простые составные части и реакции изомеризации. Двухмолекулярными называются элементарные реакции вида: А+В→Р и 2А→Р (Н2+J2=2HJ,HJ+HJ=H2+J2,CH3COOCH3+H2O=CH3COOH+CH3OHи т.д.). Значительно реже встречаются трехмолекулярные реакции А+2В→Р или 3А→Р. Во всех случаях вид и количество образующихся продуктов реакции не имеет значения, так как молекулярность определяется только числом молекул веществ, реагирующих в элементарном акте. Порядок реакции устанавливается экспериментально. Молекулярность и порядок реакции могут совпадать, а могут и различаться. Молекулярность и порядок реакции совпадают только для простых реакций, протекающих только в одну элементарную стадию без участия посторонних молекул. Молекулярность и порядок реакции не совпадают в трех основных случаях: 1) для сложных реакций; 2) для гетерогенных реакций; 3) для реакций с избытком одного из реагирующих веществ. Период полупревращения – это время, в течение которого прореагирует половина взятого вещества. Кинетическое уравнение выражает зависимость скорости хим. реакции от концентраций компонентов реакционной смеси Молекулярность-число молекул, реагирующих в в одном элементарном химическом акте. Молекулярность реакции определяется числом молекул, вступающих в химическое взаимодействие в элементарном акте реакции. По этому признаку реакции разделяются на мономолекулярные, бимолекулярные и тримолекулярные. Тогда реакции типа А —>В будут являться мономолекулярными, например: а) С16Н34 (t°C) —>CgH18 + С8Н16 - реакция крекинга углеводородов; б) CaC03 (t°C) —>СаО + С02 - термическое разложение карбоната кальция. Тримолекулярные реакции описываются общими уравнениями типа: а) А + В + С Д; б) 2А + В Д; в) 3А Д. Например: а) 2Н2 + 02 2Н20; б) 2NO + Н2N20 + Н20. Скорость реакций в зависимости от молекулярности будет выражаться уравнениями: а) V = к • СА - для мономолекулярной реакции; б) V = к • СА • Св или в) V = к • С2А - для бимолекулярной реакции; г) V = к • С • Св • С э д) V = к • С2А • Св или е) V = k • С3А- для тримолекулярной реакции.
Нередко молекулярность реакции трудно установить, поэтому используют более формальный признак - порядок химической реакции. Порядок реакции равен сумме показателей степеней концентраций в уравнении, выражающем зависимость скорости реакции от концентрации реагирующих веществ (кинетическом уравнении). Порядок реакции чаще всего не совпадает с молекулярностью ввиду того, что механизм реакции, т. е. "элементарный акт" реакции (см. определение признака молекулярности), трудно установить. Рассмотрим ряд примеров, иллюстрирующих указанное положение. 1. Скорость растворения кристаллов описывается уравнениями кинетики нулевого порядка, несмотря на мономолекулярность реакции: AgCl(TB) —>Ag+ + CI", V = k • C(AgCl(TBp= k'C(AgCl(ra}) - p - плотности и является постоянной величиной, т. е. скорость растворения не зависит от количества (концентрации) растворяемого вещества. 2. Реакция гидролиза сахарозы: СО + Н20 —> С6Н1206(глюкоза) + С6Н1206 (фруктоза) является бимолекулярной реакцией, но ее кинетика описывается кинетическим уравнением первого порядка: V=k*Ccax, так как в условиях опытов, в том числе и в организме, концентрация воды есть величина постоянная С(Н20) - const. 3. Реакция разложения водородпероксида, протекающая с участием катализаторов, как неорганических ионов Fe3+, Cu2+ металлической платины, так и биологических - ферментов, например каталазы, имеет общий вид: 2Н202 —> 2Н20 + О э т. е. является бимолекулярной. 13.Зависимость скорости реакции от концентрации. Кинетические уравнения реакций первого, второго и нулевого порядков. Экспериментальные методы определения скорости и константы скорости реакций. Элементарный акт химической реакции осуществляется в момент столкновения реагирующих частиц. Увеличение концентрации реагентов соответствует увеличению числа частиц в объеме, что приводит к более частым столкновениям, а следовательно к увеличению скорости реакции. Количественная зависимость скорости реакции от концентрации выражается законом действующих масс: Скорость простой гомогенной реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, численно равные их стехиометрическим коэффициентам.
, где а и б - стехиометрические коэффициенты реагентов, с(А) и с(В) – молярные концентрации реагентов, к- константа скорости реакции. Порядок реакции по реагенту равен показателю степени, в которую надо возвести концентрацию данного реагента в кинетическом уравнении сложной реакции, чтобы вычисленная по этому уравнению скорость была равна скорости, найденной экспериментально. Реакция нулевого порядка Кинетическое уравнение имеет следующий вид:
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ. Нулевой порядок характерен, например, для гетерогенных реакций в том случае, если скорость диффузии реагентов к поверхности раздела фаз меньше скорости их химического превращения. Реакция первого порядка Кинетическое уравнение реакции первого порядка:
Приведение уравнения к линейному виду даёт уравнение:
Реакция второго порядка Для реакций второго порядка кинетическое уравнение имеет следующий вид:
или
Измерение скорости реакции основано на определении концентрации одного из реагирующих веществ через различные промежутки времени от начала реакции. Для определения концентраций можно применять методы физико-химического анализа, основанные на зависимости физических свойств смеси от её состава (например, определение показателя преломления, угла вращения плоскости поляризации, вязкости, электрической проводимости, объёма, плотности, изменения температур замерзания и кипения, интенсивности окраски и т. п.), и методы аналитической химии (например, титрование). Поскольку концентрации по ходу реакции непрерывно меняются, то необходимо или очень быстрое измерение концентрации (методы физико-химического анализа), или торможение реакции во взятой пробе (химический контроль). Торможение может быть достигнуто охлаждением, резким разбавлением, устранением катализатора или совместным действием всех указанных факторов. Если реакция, протекающая в газовой фазе, сопровождается изменением числа молекул, то её течение удобно контролировать по изменению давления смеси во времени. К сравнительно медленным реакциям со временем полупревращения порядка получаса и более можно применять спектроскопию, масс-спектрометрию и хроматографию. Для исследования скоростей очень быстрых реакций (с периодом полупревращения до 10-7и даже 10–9с) используются специально разработанные методы и особая аппаратура. Для определения порядка реакции необходимо иметь экспериментальные данные об изменении концентрации реагирующих веществ со временем. Если в реакции участвует несколько веществ, то пользуются методом изолирования Оствальда. 14.Зависимость скорости реакции от температуры. Правило Вант - Гоффа. Температурный коэффициент скорости реакции и его особенности для биохимических процессов. Правило Вант-Гоффа Или (учебник Слесарев): Энергия активации
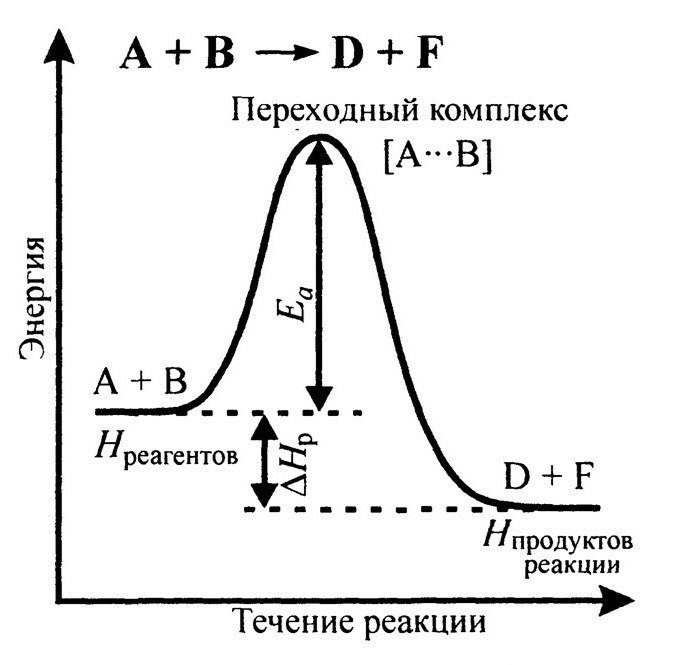
Уравнение Аррениуса Чем больше энергия активации, тем меньше будут константа и скорость химической реакции, так как в системе будет меньше число активных частиц. Стерический фактор (P)
|
||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 3725; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |










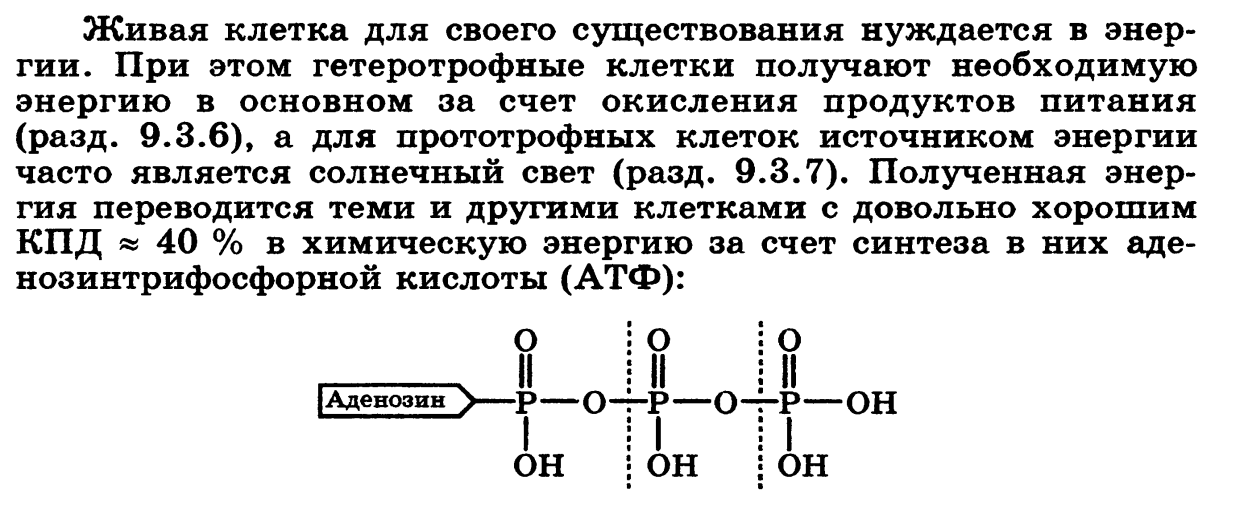





 11. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции, средняя скорость реакции в интервале, истинная скорость. Факторы, влияющие на скорость реакции.
11. Химическая кинетика как основа для изучения скоростей и механизмов биохимических процессов. Скорость реакции, средняя скорость реакции в интервале, истинная скорость. Факторы, влияющие на скорость реакции.




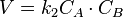

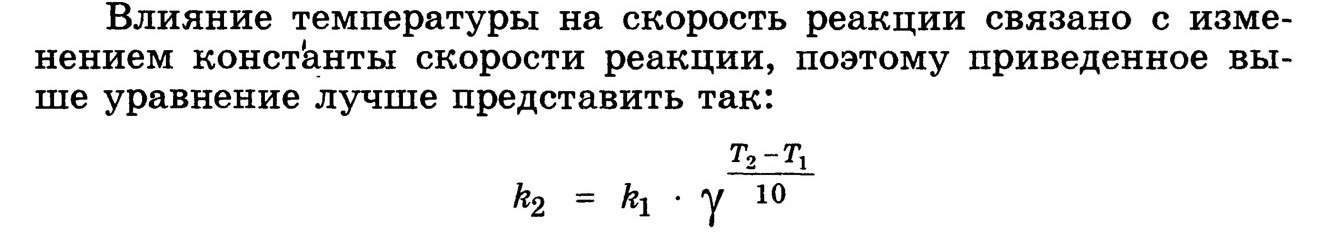
 Энергетический профиль течения реакции
Энергетический профиль течения реакции