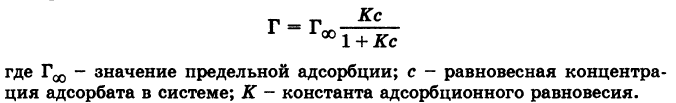Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические принципы транспорта электронов в электронотранспортной цепи митохондрий. Общие представления о механизме действия редокс-буферных систем.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте В качестве переносчиков электронов в дыхательную цепь митохондрий входят различные белки, содержащие, разнообразные функциональные группы, которые предназначены для переноса электронов. По мере продвижения по цепи от одного интермедиата к другому электроны теряют свободную энергию. На каждую пару электронов, переданных по дыхательной цепи кислороду, синтезируются три молекулы АТФ. Значительная часть свободной энергии, выделяющейся при переносе одной пары электронов, запасается в молекулах АТФ. Чем больше величина редокс-потенциала, тем сильнее окислитель и слабее сопряженный ему восстановитель. Сильный окислитель вступает в реакции с большим числом восстановителей, чем слабый, и/или вызывает более глубокое окисление восстановителей. 49.Токсическое действие окислителей (нитраты, нитриты, оксиды азота). Обезвреживание кислорода, пероксида водорода и супероксид-иона. Применение редокс-реакций для детоксикации. 1/2O2 + 2H+ +2e - = H2O ОБЕЗВРЕЖИВАНИЯ КИСЛОРОДА В ЭРИТРОЦИТАХ Высокое содержание О2 в эритроцитах является причиной образования большого количества его активных форм. Постоянным источником активных форм кислорода в эритроцитах является неферментативное окисление гемоглобина в метгемоглобин: 1). Hb (Fe2+) ® MetHb (Fe3+) +e- 2). e- + O2→О∙2
Адсорбция - поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела. Например, если поместить в водный раствор уксусной кислоты кусочек угля, то произойдёт А. — количество кислоты в растворе уменьшится, молекулы кислоты сконцентрируются на поверхности угля. Адсорбция и абсорбция — поглощение в объёме тела, объединяются общим термином сорбция. Явление А. тесно связано с особыми свойствами вещества в поверхностном слое. Например, молекулы, лежащие на поверхности раздела фаз жидкость — пар, втягиваются внутрь жидкости, т. к. испытывают большее притяжение со стороны молекул, находящихся в объёме жидкости, чем со стороны молекул пара, концентрация которых во много раз меньше концентрации жидкости. Это внутреннее притяжение заставляет поверхность сокращаться и количественно характеризуется поверхностным натяжением. По той же причине молекулы какого-либо другого вещества, оказавшиеся вблизи поверхности, притянутся к ней и произойдёт А. После А. внутреннее притяжение частично компенсируется притяжением со стороны адсорбционного слоя и поверхностное натяжение уменьшается. Изотерма адсорбции - зависимость адсорбции от равновесной концентрации растворенного вещества при постоянной температуре. Поверхностно-неактивные вещ- ва (адсорбирующие отрицательно) либо не изменяют коэффициент поверхностного натяжения водной фазы, либо незначительно его увеличивают.(большинство неорганический вещ-в: кислоты, щелочи, соли) Мера адсорбции-Г(гамма)ед. изм.-моль\м2. Уравнение Гиббса: Г=-Сср/RT Х ср. ро/ср. С При малых концентрациях пав углеводородные радикалы лежат на поверхности полярной жидкости, а полярные группировки погружены в нее. С увеличением конц. Пав в растворе число молекул, находящихся в поверхностном слое, возрастает. Это приводит в пределе к образованию на граничной поверхности насыщенного мономолекулярного адсорбционного слоя, а котором молекулы пав предельно ориентированы.-это слой Ленгмюра. 51.Адсорбция на подвижной поверхности раздела фаз. Уравнение Гиббса. Поверхностная активность, положительная и отрицательная адсорбция Адсорбция - поглощение к.-л. вещества из газообразной среды или раствора поверхностным слоем жидкости или твёрдого тела. Уравнение Гиббса: Г=-Сср/RT Х ср. ро/ср. С Гиббс вывел формулу, связывающую значение А. с изменением поверхностного натяжения. Те вещества, А. которых сильно уменьшает поверхностное натяжение, принято называть поверхностно-активными (дифильные и ассиметричные, одноатомные спирты, одноосновные карбоновые кислоты, амины, эфиры). Адсорбция может быть положительной или отрицательной. При внесении в какой-либо раствор адсорбента будут поглощаться растворитель и растворенное вещество. Если поглотится больше растворителя, чем растворенного вещества, т. е. если повысится концентрация раствора, то адсорбция будет отрицательной. Если, наоборот, поглотится больше растворенного вещества, то адсорбция будет положительной. Отрицательной адсорбцией обладают, например, сахара и многие неорганические соли при сравнительно высоких концентрациях. Такие же свойства присущи всем органическим соединениям, содержащим много гидроксильных ионов (ОН). Но веществ, обладающих отрицательной адсорбцией, значительно меньше, чем веществ с положительной адсорбцией. К последним относятся некоторые краски, алкалоиды, органические кислоты, простейшие спирты. В природе есть вещества поверхностно-неактивные. Так, поваренная соль, растворенная в воде, почти не изменяет поверхностного натяжения. Поэтому она плохо адсорбируется коллоидами. Явления адсорбции в почвенных процессах имеют большое значение. Например, состав воздуха почвы несколько иной, чем атмосферы. Он различен и в обособленных порах почвы. Поэтому корни растений могут найти нужную для них концентрацию и состав воздуха, а микробы — лучшие условия для существования. В минеральных солях, прошедших через почву, изменится соотношение катионов и анионов, что дает возможность регулировать их содержание. Явление адсорбции может играть в жизни растений не только положительную, но и отрицательную роль, например при адсорбции ядов.
Адсорбция может быть положительной или отрицательной. При внесении в какой-либо раствор адсорбента будут поглощаться растворитель и растворенное вещество. Если поглотится больше растворителя, чем растворенного вещества, т. е. если повысится концентрация раствора, то адсорбция будет отрицательной. Если, наоборот, поглотится больше растворенного вещества, то адсорбция будет положительной. Отрицательной адсорбцией обладают, например, сахара и многие неорганические соли при сравнительно высоких концентрациях.
52.Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе). Изотерма адсорбции. Ориентация молекул в поверхностном слое и структура биомембран.
ПАВ –поверхностно активные вещества, понижают поверхностное натяжение растворителя. Молекула ПАВ это вещество дифильной (двоякой) природы имеющие гидрофильную (полярную) головку (-COOH; -OH; -NH2), и гидрофобный (неполярный) хвост (углеводородный радикал. Виды ПАВ: органические соединения: спирты, кислоты алифатического ряда и их соли (мыла, сложные эфиры, амины, белки, фосфолипиды) 1. Анионактивные ПАВ, полярная группа –кислотная (соли высших карбоновых кислот) 2. Катионактивные ПАВ, полярная группа – катион (соли тетраалкиламмония) 3. Неионогенные ПАВ (полиоксиэтиленовые производные спиртов, кислот, фенолов) ПНВ-поверхностно-неактивные вещества, не изменяют поверхностное натяжение. Например, сахароза. Поверхностно-неактивные вещества обладают следующими характерными особенностями: а) обладают большим по сравнению с растворителем поверхностным натяжением; б) имеют более высокую растворимость. Правило Дюкло-Траубе: Поверхностная активность ПАВ одного и того же гомологического ряда в разбавленных водных растворах при одинаковой молярной концентрации увеличивается в 3-3,5 раза при увеличении углеводородной цепи на группу СН2. Пример: изотермы поверхностного натяжения для водных растворов карбоновых кислот. Из рисунка видно: чем длинней углеводородная цепь, тем эффективней снижается поверхностное натяжение водного раствора с ростом концентрации ПАВ . Изотерма адсорбции – функциональная зависимость количества адсорбированного поверхностью вещества от давления или концентрации этого вещества в другой фазе Г=f(p)T=const, Г=f(с)T=const.При монослойной локализованной адсорбции на однородной поверхности Г=f(p) описывается изотермой Ленгмюра.
Ориентация молекул в поверхностном слое и структура биомембран. 53.Адсорбционные равновесия на неподвижных границах раздела фаз. Физическая адсорбция и хемосорбция. Адсорбция газов на твердых телах, факторы, влияющие на этот процесс. Уравнение Ленгмюра, его анализ.
Вещество, на поверхности которого происходит Адсорбция, называется адсорбентом, а поглощаемое из объёмной фазы — адсорбатом. В зависимости от характера взаимодействия между молекулой адсорбата и адсорбентом А. принято подразделять на физическую А. и хемосорбцию. Менее прочная физическая А. не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия, которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто А. обусловлена и физическими и химическими силами, поэтому не существует чёткой границы между физикой А. и хемосорбцией. Адсорбированные молекулы рано или поздно покидают поверхность молекулы — десорбируются. Время, в течение которого молекула находится на поверхности, называется временем Адсорбции Времена А. могут колебаться в очень широких пределах. Скоростью А. (соответственно скоростью десорбции) называется количество молекул, адсорбирующихся (или десорбирующихся) за единицу времени, оба значения величин относят к единице поверхности или массы адсорбента. Скорость хемосорбции, как и скорость любого химического процесса, чаще всего увеличивается с повышением температуры. Если скорости А. и десорбции равны друг другу, то говорят, что установилось адсорбционное равновесие. В состоянии равновесия количество адсорбированных молекул остаётся постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и др.). Уравнение Ленгмюра:
Теория адсорбции Ленгмюра: 1. Частицы вещества располагаются только на активных центрах адсорбента. 2. Каждая частица адсорбата занимает 1 активный центр адсорбента. 3. Адсорбция заканчивается образованием мономолекулярного слоя. 4. Процесс адсорбции обратимый 5. Через некоторое время адсорбированные молекулы покидают активные центры и их место занимают активные молекулы. 6. Допускается, что взаимодействие между адсорбированными молекулами отсутствует. Адсорбция газов на твердом адсорбенте зависит от следующих факторов: 1. природы и площади поверхности адсорбента 2. природы поглощаемого газа или пара 3. концентрации или давления газа или пара 4. температуры
Молекулярная адсорбция заключается в конкуренции между растворенным веществом и растворителем за возможность взаимодействовать с адсорбционными центрами на поверхности твердого адсорбента. При молекулярной адсорбции природа растворителя должна сильно отличаться от природы растворенного вещества природы адсорбента. Другими словами: чем хуже данный растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества. Также при повышении температуры адсорбция веществ из растворов обычно уменьшается. Влияние природы поглощаемого вещества определяется несколькими правилами: Во-первых правилом "подобное взаимодействует с подобным". Во-вторых, правилом Шилова: чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента. Правило Ребиндера: на поверхности раздела фаз прежде всего адсорбируются те вещества, при адсорбции которых происходит выравнивание полярностей соприкасающихся фаз, причем с увеличением разности полярности фаз способность к адсорбции этих веществ возрастает. Поэтому эффективней всего адсорбируются вещества, молекулы которых дифильны: включают гидрофильную (полярную) головку и гидрофобный (неполярный) хвост. При наличии в растворе вещества, молекулы которого дифильны, будет происходить их эффективная адсорбция на твердом адсорбенте с самопроизвольной четкой ориентацией их молекул на границе раздела, выравнивающей полярности фаз. Полярный фрагмент всегда обращен к полярной фазе, а неполярный фрагмент- к неполярной фазе.
Ионная адсорбция заключается в адсорбции ионов из растворов электролитов на поверхности твердых веществ, кристаллическая решетка которых состоит из ионов или полярных молекул, т.е. на полярных адсорбентах. При ионной адсорбции на поверхности адсорбента вследствие адсорбции ионов, называемых потенциалопределяющими, возникает определенный заряд, который притягивает из раствора противоположно заряженные ионы - противоионы; в результате на границе раздела фаз возникает двойной электрический слой. Скорость ионной адсорбции меньше скорости молекулярной адсорбции, так как скорость диффузии сольватированных ионов меньше скорости диффузии молекул и, кроме того, адсорбции ионов предшествует более медленный, чем у молекул, процесс десольватации. Ионная адсорбция не всегда обратима, так как она может сопровождаться хемосорбцией, приводящей, например, к образованию малорастворимого вещества. Ионная адсорбция зависит от следующих факторов: 1. Радиуса иона: чем больше радиус, тем лучше ион адсорбируется. 2. От заряда иона: чем больше заряд, тем лучше адсорбируется. 3. От степени ионизации и гидратации. 4. От Рн среды В животных организмах явления адсорбции также играют очень большую роль в их жизнедеятельности. Роль адсорбции обусловлена наличием в организме огромного количества самых разнообразных поверхностей раздела - стенок сосудов, поверхности клеток, клеточных ядер и вакуолей, коллоидных частиц протоплазмы и, наконец, поверхности раздела между организмом и средой. Особенно важную функцию выполняет поверхность раздела между организмом и средой для низших организмов и организмов, живущих в воде, так как ей принадлежит существенная роль в процессах питания и обмена веществ. Исследования последних лет показали, что пищевые вещества, как правило, являются поверхностно-активными веществами, и потому первым этапом их усвоения является адсорбция, а процесс их химического превращения уже вторичен. Исследования показали, что эритроциты являются переносчиками различных веществ, в том числе аминокислот, которые они разносят и передают клеткам и различным тканям организма. Количество эритроцитов в крови взрослого человека примерно 5 000 000 в 1 нм3. У здорового мужчины в среднем на 1 кг массы приходится 450 миллиардов эритроцитов, 27 триллионов на весь организм. Учитывая, что диаметр эритроцита 7—8 мкм, можно легко подсчитать, что общая поверхность эритроцитов всей крови человека составит примерно 3200 м2. Большинство реакций, протекающих в организме, совершается при непосредственном участии ферментов-катализаторов. Исследования показали, что первые стадии действия любого фермента сводятся к адсорбции субстрата на поверхности ферментного комплекса, и только после этого фермент проявляет свое специфическое каталитическое действие.
Гемосорбция - метод лечения, направленный на удаление из крови различных токсичных продуктов и регуляцию гомеостаза путем контакта крови с сорбентом вне организма. При контакте крови с гемосорбентом наблюдается конкуренция за активные центры между веществами, подлежащими удалению, и веществами, наличие которых обеспечивает жизненно необходимые функции. Использование неспецифических сорбентов делает процедуру гемосорбции практически неуправляемой, так как при этом удаляются и токсиканты, и вещества, находящиеся в плазме в норме. Эффективность этого метода лечения в настоящее время связана с созданием высокоспецифичных сорбентов конкретных метаболитов, ионов, токсинов.
Дисперсные системы. Классификация дисперсных систем по степени дисперсности; по агрегатному состоянию фаз; по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой. Природа коллоидного состояния. По размеру: Грубодисперсные - суспензии, эмульсии,пены,аэрозоли. Мутные. Не проходят через бумажный фильт. 10-6 -10-4 Коллоидно-дисперсные: коллоидные растворы. Прозрачные, опалесцируют при боковом освещении. Проходят через бумажный фильтр, но не проходят через животные и растительные мембраны. 10-9 -10-6 Молекулярно-дисперсные: истинные растворы низкомолекулярных веществ. Прозрачные. Проходят через животные и растительные мембраны. 10-9 - 10-10 По агрегатному сост.:
Колл о идная х и мия, традиционное название физической химии дисперсных систем и поверхностных явлений. Термин «коллоиды» — синоним высокодисперсных (микрогетерогенных) систем, то есть дисперсных систем с наиболее развитой поверхностью раздела фаз. К. х. изучает своеобразные процессы и явления, обусловленные особенностями высокодисперсного состояния тел. К ним относятся, например, самопроизвольное укрупнение частиц твёрдой дисперсной фазы или капель жидкости (коагуляция и коалесценция) как проявление термодинамической (агрегативной) неустойчивости дисперсных систем; застудневание жидких дисперсных систем с образованием гелей и возникновение пространственных дисперсных структур; взаимодействие соприкасающихся тел (трение, адгезия) и изменение этого взаимодействия под влиянием веществ, адсорбирующихся на поверхностях соприкосновения; явления в тонких жидких и твёрдых плёнках; самопроизвольное диспергирование жидкостей и твёрдых тел. 56. Методы получения и очистки коллоидных растворов. Получение эмульсий, суспензий, эмульсий, коллоидных растворов. Диализ, электродиализ, ультрафильтрация. Физико-химические принципы функционирования искусственной почки. Методы диспергирования (физические): 1. Механическое дробление, которое осуществляется в шаровых и коллоидных мельницах. 2. Действием ультразвука (обрабатывают водные суспензии липодов для получения лизосом) 3. Электрическое распыление в вольтовой дуге (фуллирен получают из графита, полости которого заполняют лекарственными препаратами) (Химические): 1. Метод пептизации – дробление к свежеприготовленному осадку добавляем пептизатор и получаем, переводим в более мелкие частицы. Механизм пептизации: ионы пептизатора адсорбируются на поверхности частиц рыхлого свежее образованного осадка, придают им определенный заряд. Благодаря этому частицы взаимно отталкиваются и наблюдается распад более крупных частиц осадка на мелкие. Конденсационный метод (физические): 1.Замена растворителя. Вещество, ранее необходимое в растворенном состоянии выделяют из раствора. (химически): 1)Метод восстановления
2)Обменный метод 3)Метод гидролиза 4)Метод окисления Методы очистки коллоидных растворов:
Ультрафильтрация- отделение дисперсной фазы от дисперсной среды через специальный фильтр. Фильтрацию проводят под давлением. В осноке метода лежит «продавливание» разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы нмв.
|
||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 2791; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.016 с.) |