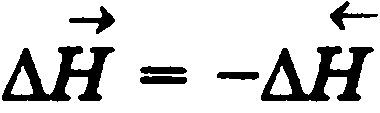Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Применение первого начала термодинамики к биосистемамСодержание книги
Поиск на нашем сайте
Частным случаем закона сохранения энергии в применении к процессам, сопровождающимся тепловыми явлениями, выступает первое начало (или первый закон) термодинамики, который можно сформулировать следующим образом: подведенное к системе тепло Q идет на увеличение ее внутренней энергии ΔU и на совершение системой работы А против внешних сил: Q = Δ U + А Система может переходить из одного состояния в другое различными путями. Но в соответствии с законом сохранения энергии изменение внутренней энергии ΔU системы не зависит от пути перехода: оно одинаково во всех случаях, если одинаковы начальное и конечное состояния системы. Количество же теплоты и количество работы зависят от этого пути. Однако, как бы не менялись значения Q и А при разных путях перехода системы из одного состояния в другое, их алгебраическая сумма будет всегда одинаковой, если только одинаковы начальное и конечное состояния системы.
На основании первого начала термодинамики можно сделать несколько важных выводов. 1. В изолированной системе сумма всех видов энергии есть величина постоянная.2. Невозможно создать вечный двигатель первого рода, который производил бы работу без подведения энергии извне, т.к. производимая системой работа будет всегда меньше, чем теплота, затраченная на ее производство. в термодинамике используют новую величину – энтальпию или теплосодержание системы Н, определяемую соотношением: Н = U + рV Энтальпия больше внутренней энергии на величину работы расширения, совершенной при изменении объема системы от 0 до V. Как и внутренняя энергия, энтальпия является функцией состояния и определить ее абсолютное значение нельзя. Можно только измерить изменение ΔН при переходе системы из одного состояния в другое: ΔН = Н2 – Н1 = (U2 +рV2) – (U1 + рV1) = U2 – U1 + (рV2 – рV1) = ΔU + р(V2 – V1) = ΔU + рΔV По первому закону во всех явлениях природы энергия не может исчезнуть бесследно или возникнуть из ничего. Энергия может только превращаться из одной формы в другую в строго эквивалентных соотношениях. Этот закон является универсальным и подтверждается всем опытом человечества. Поступление пищи обеспечивает энергию, которая используется для выполнения различных функций организма или сохраняется для последующего использования. Энергия высвобождается из пищевых продуктов в процессе их биологического окисления, которое является многоступенчатым процессом. Пищевые вещества окисляются вплоть до конечных продуктов, которые выделяются из организма. Например, углеводы окисляются в организме до углекислого газа и воды. Такие же конечные продукты образуются при сжигании углеводов в калориметре: C6H12O6 + 6O2 = 6CO2 + 6H2O Величина энергии, высвобождаемой из каждого грамма глюкозы в этой реакции, составляет 4,1 килокалории (кКал). Столько же энергии, образуется при окислении глюкозы в живых клетках, несмотря на то, что процесс окисления в них является многоступенчатым процессом и происходит в несколько стадий. Этот вывод основан на принципе Гесса, который является следствием первого закона термодинамики: тепловой эффект многоступенчатого химического процесса не зависит от его промежуточных этапов, а определяется лишь начальным и конечным состояниями системы. Таким образом, исследования с помощью калориметра показали среднюю величину физиологически доступной энергии, которая содержится в 1 грамме трех пищевых продуктов (в килокалориях): углеводы - 4,1; белки - 4,1; жиры - 9,3. С другой стороны, в конечном итоге вся энергия, поступившая в организм, превращается в теплоту. Также при образовании АТФ лишь часть энергии запасается, большая - рассеивается в форме тепла. При использовании энергии ATФ функциональными системами организма большая часть этой энергии также переходит в тепловую. Оставшаяся часть энергии в клетках идёт на выполнении ими функции, однако, в конечном счёте, превращается в теплоту. Например, энергия, используемая мышечными клетками, расходуется на преодоление вязкости мышцы и других тканей. Вязкое перемещение вызывает трение, что приводит к образованию тепла. Другим примером является расход энергии, передаваемой сокращающимся сердцем крови. При течении крови по сосудам вся энергия превращается в тепло вследствие трения между слоями крови и между кровью и стенками сосудов. Следовательно, по существу вся энергия, потраченная организмом, в конечном счете, преобразуется в теплоту. Из этого принципа существует лишь единственное исключение: в случае, когда мышцы выполняют работу над внешними телами. Если человек не выполняет внешней работы, то уровень высвобождения организмом энергии можно определить по величине общего количества теплоты, выделенной телом. Для этого применяют метод прямой калориметрии, для реализации которого используют большой, специально оборудованный калориметр. Организм помещают в специальную камеру, которая хорошо изолирована от среды, то есть не происходит обмена энергией с окружающей камеру средой. Количество теплоты, выделенной исследуемым организмом, можно точно измерить. Эксперименты, выполненные этим методом, показали, что количество энергии, поступающей в организм, равно энергии, выделяющейся при проведении калориметрии. Прямая калориметрия в проведении трудоёмка, поэтому в настоящее время используют метод непрямой калориметрии, который основан на вычислении энергетического выхода организма по использованию им кислорода.
5. Стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Стандартная энтальпия реакции. Закон Гесса. Формулировка. Математическое выражение. Следствия из закона Гесса.
Стандартная энтальпия сгорания ΔHoсгор – тепловой эффект реакции сгорания одного моля вещества до образования высших оксидов. Для органических веществ –до CO2(г) и H2O(ж). Теплота сгорания негорючих веществ принимается равной нулю. Теплота сгорания топлива характеризует его теплотворную способность. Стандартная энтальпия образования вещества (ΔfH0) – увеличение или уменьшение энтальпии, сопровождающее образование 1 моль вещества из простых веществ, при условии, что все участники реакции находятся в стандартном состоянии Стандартная энтальпия сгорания вещества (ΔсH0) – уменьшение энтальпии при окислении в избытке кислорода 1 моль вещества, взятого в стандартном состоянии, до конечных продуктов окисления. Закон Гесса – энергия не создаётся и не уничтожается, а лишь переходит из одного вида энергии в другой.
Закон Гесса Тепловой эффект реакции зависит только от природы и состояния исходных вещ-в и не зависит от пути, по которому реакция протекает Следствие 1. Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
ΔHof,i - стандартная энтальпия образование веществ vi – стехиометрические коэффициенты
Следствие 2. Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
ΔHoс,i- стандартная энтальпия сгорания веществ vi – стехиометрические коэффициенты
Следствие 3. Энтальпия реакции равна разности сумм энергий связей E св исходных и конечных реагентов с учетом их стехиометрических коэффициентов. В ходе химической реакции энергия затрачивается на разрушение связей в исходных веществах (ΣEисх) и выделяется при образовании продуктов реакции (–ΣEпрод). Отсюда
Следовательно, экзотермический эффект реакции свидетельствует о том, что образуются соединения с более прочными связями, чем исходные. В случае эндотермической реакции, наоборот, прочнее исходные вещества. При определении энтальпии реакции по энергиям связей уравнение реакции пишут с помощью структурных формул для удобства определения числа и характера связей.
Следствие 4. Энтальпия реакции образования вещества равна энтальпии реакции разложения его до исходных веществ с обратным знаком.
Следствие 5. Энтальпия гидратации равна разности энтальпий растворения безводной соли (ΔHoраств.б/с)и кристаллогидрата (ΔHoраств.крист)
|
|||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 2770; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |