
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбція на межі тверде тіло – рідкий розчин.Содержание книги
Поиск на нашем сайте
Адсорбція на межі тверде тіло – рідкий розчин в загальних рисах подібна до адсорбції на поверхні тверде тіло – газ, але ускладнюється тим, що з рідкого середовища одночасно адсорбується як мінімум два компоненти - розчинник та розчинена речовина. Між цими компонентами відбувається конкуренція за місце в поверхневому шарі. Розглядаючи адсорбцію розчинів на поверхні твердого тіла розрізняють два випадки: адсорбцію неелектролітів – молекулярну адсорбцію, та адсорбцію електролітів – іонну адсорбцію.
Молекулярна адсорбція
Залежність молекулярної адсорбції з розчину на твердому тілі від концентрації для розведених розчинів добре описується рівняннями Фрейндліха (4.41) та Ленгмюра (4.37). Рівняння адсорбції Гіббса для даного виду адсорбції застосовувати проблематично, тому що визначення поверхневого натягу на межі тверде тіло – розчин технічно важко здійснити. Визначальне значення для молекулярної адсорбції має полярність адсорбату та адсорбенту: неполярні речовини краще адсорбуються на неполярних адсорбентах, а полярні на полярних. Вплив природи адсорбату на його здатність до адсорбції на твердому тілі виражає правило вирівнювання полярностей Ребіндера: речовина буде адсорбуватися на поверхні поділу фаз, якщо її присутність в поверхневому шарі веде до вирівнювання різниці полярностей цих фаз, тобто адсорбція буде відбуватися, якщо полярність адсорбату знаходиться між полярностями адсорбенту і розчинника. З правила Ребіндера можна зробити висновок: при адсорбції дифільних молекул на межі полярний розчинник – неполярний адсорбент (або навпаки) дифільні молекули будуть в поверхневому шарі орієнтуватися таким чином, щоб полярна частина молекули була повернена до полярної фази, а неполярна до неполярної.
4.4.2. Іонна адсорбція
Іонна адсорбція відбувається тільки на полярних адсорбентах, вона як правило незворотна і зростає із збільшенням температури, що вказує на хімічну природу сил, що діють між іонами та адсорбентом. Іони з певним знаком заряду адсорбуються на мікроділянках поверхні адсорбенту з протилежним знаком заряду. Якщо в розчині електроліту є різні іони з однаковим знаком заряду то, як правило адсорбується тільки один з них тобто відбувається вибіркова (селективна) адсорбція.
Згідно правила вибіркової адсорбції Панета - Фаянса перевагу при адсорбції мають іони, які входять до складу кристалічної ґратки твердої поверхні. Ці іони здатні добудовувати кристалічну ґратку поверхні. Такі іони називають родинними іонами. Наприклад, на поверхні кристалів AgI, що знаходяться в водному розчині KI, першочергово будуть адсорбуватися іони I-. Добудовувати кристалічну ґратку можуть не тільки родинні іони, але і ізоморфні з ними, тобто іони з близькою до них структурою. Наприклад, на поверхні кристалів AgI, що знаходяться в водному розчині KCl, будуть переважно адсорбуватися іони Cl-. При адсорбції з розчину неродинних (індиферентних) іонів перевагу мають іони з більшою валентністю. Чим більша валентність іона, тим сильніше він притягується протилежно зарядженими мікроділянками поверхні. K+<<Ca2+<<Al3+<<Th4+ Серед іонів з однаковою валентністю краще адсорбуються іони з більшим іонним радіусом. Чим більший радіус іона, тим менше він поляризований і тим тонша його гідратна оболонка.
Рис. 34. Співвідношення між дійсними та гідратованими радіусами іонів.
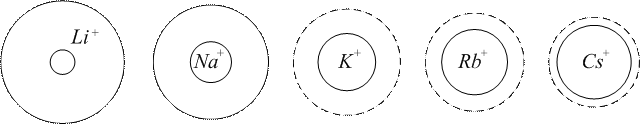
Іони з однаковою валентністю, розташовані в порядку зростання їх адсорбційної здатності, називають ліотропними рядами, або рядами Гофмейстера. Li+<Na+<K+<Rb+<Cs+ Mg2+ <Ca2+ <Sr2+ <Ba2+ F-<Cl-<Br-<I-
Якщо на поверхні адсорбенту попередньо були адсорбовані іони, то при введенні в розчин нових іонів можлива обмінна адсорбція. При цьому адсорбент буде поглинати певну кількість іонів з розчину і одночасно виділяти в розчин еквівалентну кількість іонів того самого знаку. Обмінну адсорбцію іонів на поверхні характеризує рівняння Нікольского:
g1, g2 – кількості 1-го та 2-го іонів на поверхні адсорбенту; с1, с2 – концентрації іонів в розчині; z1, z2 – заряди іонів; k – константа рівноваги реакції іонного обміну. Обмінна адсорбція має велике значення в природі та техніці. Природні ґрунти здатні поглинати деякі іони, наприклад K+, NH4+, і виділяти еквівалентні кількості інших катіонів, наприклад Ca2+, Mg2+. Іонообмінну адсорбцію використовують для пом’якшення води. З цією метою використовують синтетичні та природні іоніти – речовини, що здатні до іонного обміну.
|
||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 1717; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.131.90.193 (0.01 с.) |

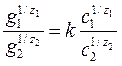 , де (4.71)
, де (4.71)


