
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ізотерма адсорбції (закон) Генрі
В залежності від природи адсорбату і адсорбенту адсорбцію можна класифікувати наступним чином: - адсорбцію газів на твердій поверхні; - адсорбцію розчиненої речовини на межі розчин – тверде тіло; - адсорбцію розчиненої речовини на межі розчин – газ. Адсорбція газу на твердій поверхні є найпростішим випадком адсорбції, тому що система тверде тіло – газ складається всього з двох компонентів. Тому адсорбція газу твердим тілом зручна для теоретичного розгляду явища адсорбції. Припустимо, що тверда поверхня на якій відбувається адсорбція, є однорідною і в результаті адсорбції на ній утворюється мономолекулярний шар адсорбованих молекул. Якщо вважати поверхневий шар окремою фазою то можна розглядати адсорбцію, як процес вирівнювання хімічних потенціалів речовини, що адсорбується на поверхні і в об’ємі системи. Хімічний потенціал компонента в об’ємі дорівнює: mv = mvo + RTlnav (4.27) Хімічний потенціал компонента на поверхні:
А – адсорбція (концентрація на поверхні). В стані рівноваги хімічний потенціал компонентів в об’ємі і поверхневому шарі вирівнюється. mvo + RTlnav = mo + RTlna (4.29)
КГ – константа Генрі (не залежить від концентрації). av = cgv – активність компонента в об’ємі системи. a = Аg – активність компонента на поверхні.
При значеннях концентрації близької до нуля gv ≈ g ≈ 1, в цьому випадку одержуємо рівняння ізотерми адсорбції Генрі: А=КГс, або А=КГр (4.34)
Рис. 20. Ізотерма адсорбції Генрі. Величина адсорбції при малих значеннях тиску або концентрації прямо пропорційна їх величині. Ізотерма адсорбції Генрі описує адсорбцію на однорідній поверхні в мономолекулярному шарі при малих значеннях тиску або концентрації. Відхилення від прямої лінії при збільшенні тиску або концентрації обумовлене зменшенням числа вільних адсорбційних центрів на поверхні адсорбенту, та впливом коефіцієнтів активності компонентів системи.
Теорія адсорбції Ленгмюра
Теорія адсорбції створена Ленгмюром в 1915 р. стала фундаментальним внеском в теорію адсорбції. При розробці своєї теорії адсорбції Ленгмюр зробив наступні припущення: Адсорбція відбувається лише на певних адсорбційних центрах (молекули не рухаються по поверхні адсорбенту).
Кожний адсорбційний центр взаємодіє тільки з однією молекулою утворюючи мономолекулярний шар. Адсорбційні центри енергетично еквівалентні, а поверхня – еквіпотенціальна. Число адсорбційних центрів на одиницю поверхні є величина стала. Адсорбовані молекули не взаємодіють між собою. В теорії Ленгмюра адсорбція розглядається як псевдохімічна рівноважна реакція між молекулою адсорбату В і адсорбційним центром на поверхні А’ в результаті якої утворюється комплекс А’В. A’ + B = A’B Константа рівноваги цієї реакції дорівнює:
сAB = A – адсорбція (концентрація адсорбату на поверхні адсорбенту). с = сB - концентрація адсорбату в об’ємі системи. сA =A0 = A∞ - A число вільних адсорбційних центрів. A∞ - гранична адсорбція (ємність моношару).
Якщо виразити з цього рівняння адсорбцію одержуємо рівняння ізотерми адсорбції Ленгмюра:
Так як концентрація газів пропорційна парціальним тискам то ізотерма адсорбції Ленгмюра виражена через тиск має наступний вигляд:
Графічно залежність адсорбції від тиску або концентрації представлена на (рис.21). Цю залежність можна умовно поділити на три ділянки. Проаналізуємо граничні ділянки ізотерми адсорбції: І ділянка: с → 0, Кс <<1, A = A∞Kс = КГс тобто на цій ділянці рівняння Ленгмюра перетворюється на рівняння Генрі. ІІІ ділянка: с → ∞, A ≈ A∞, тобто поверхня адсорбату повністю заповнена молекулами адсорбенту.
Рис. 21. Ізотерма адсорбції Ленгмюра.
Для розрахунку параметрів рівняння Ленгмюра його зручно використовувати в лінійній формі:
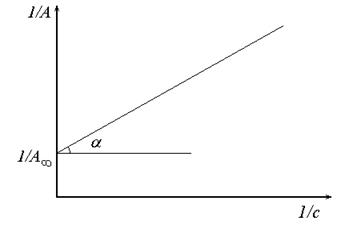
Якщо побудувати ізотерму адсорбції в координатах 1/А=f(1/с) то одержимо пряму лінію, яка відтинає на осі ординат відрізок рівний 1/А∞ з тангенсом кута нахилу
За значенням А∞ можна розрахувати питому поверхню адсорбенту: Sпит = A∞NАSо, де (4.40) Sо – площа, яку займає одна молекула в поверхневому шарі.
Рис. 22. Визначення констант рівняння Ленгмюра.
Ізотерма адсорбції Ленгмюра добре описує адсорбцію на однорідній поверхні в мономолекулярному шарі при будь-яких значеннях тиску і концентрації.
Ділянка ІІ (рис.21) можна також описати емпіричним рівнянням адсорбції Фрейндліха A = KFс1/n , або A = KFр1/n (4.41) В лінійній формі рівняння Фрейндліха має вигляд: ln A = ln KF +1/n∙lnс (4.42) На (рис.23) наведено графічний метод визначення констант рівняння Фрейндліха.
Рис. 23. Визначення констант рівняння Фрейндліха. При адсорбції газів з їх суміші величини їх адсорбцій додаються, а вільних адсорбційні центри є спільними для багатокомпонентної системи. Константи рівноваги адсорбції кожного з газів можна записати, як:
Величина адсорбції для компонента суміші дорівнює:
Aі = A0Kіpі (4.44)
При адсорбції з суміші газів кожний з компонентів адсорбується завжди в меншій кількості, ніж при адсорбції одного з цих газів. При цьому, чим краще адсорбується газ, тим краще відбувається його адсорбція з суміші. В деяких випадках адсорбція одного з компонентів може бути настільки значною, що адсорбція інших компонентів практично не відбувається. Наприклад при адсорбції парів органічних речовин на активованому вугіллі, вплив компонентів повітря на адсорбцію практично відсутній.
Приклад 4.1 При дослідженні адсорбції водяної пари макропористим силікагелем при кімнатній температурі отримана ізотерма адсорбції. При представленні її у вигляді (1/А) = f(1/р) - одержали пряму лінію, яка відсікає на осі ординат відрізок b = 0,35 кг/моль, а тангенс кута нахилу прямої становить tg α = 0,00575(кг∙Па/моль). Запишіть рівняння дослідженої ізотерми і розрахуйте його константи. Досліджена ізотерма адсорбції Ленгмюра, яка в лінійній формі має вигляд:
(1/А∞)= 0,35(кг/моль), А∞=2,9(моль/кг); Константи ізотерми адсорбції Ленгмюра дорівнюють: tg α = (1/А∞К)=0,00575(кг∙Па/моль); К= 61 Па-1 Приклад 4.2 При дослідженні адсорбції діоксиду вуглецю на активованому вугіллі при 293К отримали прямолінійну залежність ln A = f (ln p), яка відсікає відрізок на осі ординат b = 8,80, а тангенс кута нахилу прямої становить tg α = -0,45. Запишіть рівняння ізотерми адсорбції і визначить його константи. Досліджена ізотерма описується емпіричним рівнянням Фрейндліха A = KFp1/n; ln A = ln KF +1/n ∙ln p, Константи рівняння Фрейндліха дорівнюють: ln КF=8,8; КF = 6634; (1/n)= -0,45; n = -2,2.
|
||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 716; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.4.65 (0.043 с.) |
 m = mo + RTlna (4.28)
m = mo + RTlna (4.28)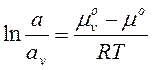 (4.30)
(4.30) (4.31)
(4.31) (4.32)
(4.32) (4.33)
(4.33)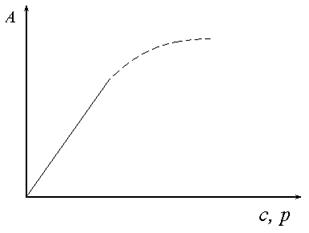
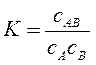 (4.35)
(4.35)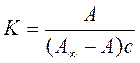 (4.36)
(4.36)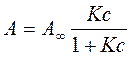 (4.37)
(4.37) (4.38)
(4.38)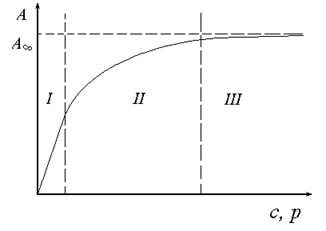
 (4.39)
(4.39)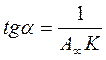

 ;
; 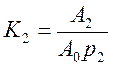 ;...;
;...; 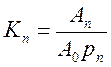 (4.43)
(4.43)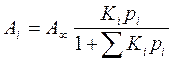 (4.45)
(4.45) ;
;


