Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Фундаментальне рівняння адсорбції Гіббса
Перерозподіл компонентів розчину між об’ємом і поверхневим шаром викликає зміну хімічних потенціалів компонентів внаслідок чого відбувається перехід поверхневої енергії в хімічну. Для опису цього процесу в рівноважних умовах використаємо об’єднане рівняння першого і другого закону термодинаміки для поверхневого шару з врахуванням поверхневої та хімічної енергії. dU = TdS + Smidni – pdV + sdS (4.11) ni - надлишок і -того компонента в поверхневому шарі. Для поверхневого шару pdV=0, тому: dU = TdS + Smidni + sdS (4.12) Оскільки внутрішня енергія поверхні пропорційна екстенсивним величинам, то перейдемо від змін функцій до самих функцій: U = TS + Smini + sS (4.13) Повний диференціал поверхневої енергії дорівнює: dU = TdS +SdT + Smidni + Snidmi + sdS +Sds (4.14) Якщо від рівняння (4.14) відняти рівняння (4.11) отримуємо: SdT + SnidmI + Sds =0 (4.15) Якщо температура залишається незмінною (Т=const), то: Sds + SnidmI =0 (4.16) -Sds = SnidmI (4.17) Розділимо це рівняння на площу міжфазної поверхні S -ds = S(ni /S)dmI (4.18) Позначимо надлишок речовини в поверхневому шарі (адсорбція за Гіббсом), як Гі = ni/S, тоді: -ds = S Гі dmI (4.19) Якщо хімічні потенціали всіх j компонентів системи, крім і – того залишаються незмінними, тоді для і – того компонента:
Зміна хімічного потенціалу компонента системи дорівнює:
Для розведених розчинів можна вважати, що gi≈1, ai=сi∙gi; тому ai≈сi Замінивши активність у рівнянні (4.22) на концентрацію при сталих значеннях об’єму, температури і хімічних потенціалів всіх j компонентів одержуємо рівняння адсорбції Гіббса.
На основі експериментально визначеної залежності поверхневого натягу від концентрації, за допомогою рівняння адсорбції Гіббса, можна побудувати ізотерму адсорбції.
Рис. 17. Побудова ізотерми адсорбції Гіббса.
Тангенс кута нахилу дотичної в точці чисельно дорівнює значенню першої похідної. Тому будують дотичні до кривої залежності поверхневого натягу від концентрації і визначають тангенси їх кута нахилу за якими розраховують значення адсорбції Г при даній концентрації.
Теплота адсорбції. При адсорбції газів, як і при їх конденсації, виділяється теплота DHадс<0. Розрізняють два способи вираження теплоти адсорбції - інтегральний та диференційний. Інтегральна теплота адсорбції це загальна кількість теплоти Q, що виділяється при адсорбції, віднесена до одиниці маси адсорбенту:
DHінт = Q/т (4.24) де т - маса адсорбенту.
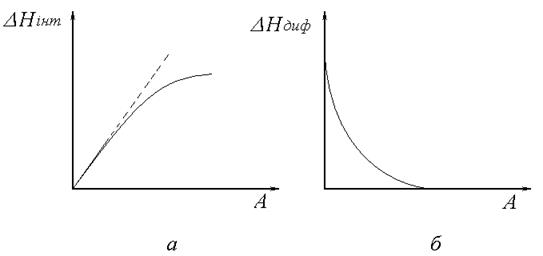
Рис. 18. Залежність теплоти адсорбції від кількості адсорбованої речовини.
Оскільки активні центри на поверхні реального адсорбенту не є однаковими, тобто поверхня енергетично неоднорідна, залежність DH від кількості адсорбату не є лінійною (рис.18,а). Спочатку адсорбція відбувається на найбільш активних поверхневих центрах, при цьому виділяється найбільша кількість теплоти. По мірі заповнення поверхні вступають в дію менш активні центри, внаслідок чого виділення теплоти зменшується. Цим пояснюється відхилення від лінійності залежності DHінт=f(А). В зв’язку з цим ввели поняття диференційної теплоти адсорбції DHдиф, яка є відношенням нескінченно малої кількості теплоти dQ до нескінченно малої кількості адсорбованої речовини dп (рис.18,б) DHдиф = dQ/dn (4.25) Дослідження теплоти адсорбції різних газів на різноманітних поверхнях зробило великий внесок як в розуміння природи адсорбційних процесів і явищ гетерогенного каталізу, так у вирішенні багатьох практичних питань, зокрема при підборі та розробці ефективних адсорбентів та каталізаторів.
|
|||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 489; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.132.200 (0.023 с.) |
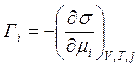 (4.20)
(4.20) (4.21)
(4.21)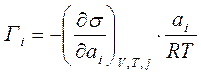 (4.22)
(4.22)
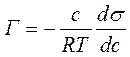 (4.23)
(4.23)
 ;
;  ;
; 
 ;
;  ;
;