
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теорія полімолекулярної адсорбції БЕТСодержание книги
Поиск на нашем сайте
Дослідження процесів адсорбції газів на поверхні твердих тіл показали, що ізотерми Ленгмюра є характерними для систем, в яких відбувається сильна взаємодія адсорбованих молекул з активними центрами поверхні, наприклад, при хемосорбції. У більшості випадків процес накопичення молекул на поверхні не закінчується утворенням мономолекулярного шару. Молекули продовжують адсорбуватися в другому, третьому та подальших шарах, з утворенням полімолекулярної плівки. При тисках близьких до тиску насиченої пари ps величина адсорбції різко зростає і процес закінчується об’ємною конденсацією пари. Для таких процесів ізотерма адсорбції має S-подібний вигляд (рис.24).
Рис. 24. Ізотерма полімолекулярної адсорбції.
У 1935-40 рр. Брунауер, Еммет та Теллер запропонували теорію полімолеклярної адсорбції, яка згодом отримала назву теорія БЕТ (згідно перших букв прізвищ її засновників). Ця теорія ґрунтується на наступних положеннях: 1. На поверхні адсорбенту є певна кількість рівноцінних в енергетичному відношенні активних центрів, що утримують молекули адсорбату. 2. Взаємодією молекул адсорбованих на сусідніх адсорбційних центрах нехтують. 3. Кожна адсорбована молекула є центром адсорбції для наступного шару. 4. Статистична сума станів молекул у всіх шарах крім першого така сама, як і в рідкому стані.
Рис. 25. Схема полімолекулярної адсорбції.
Полімолекулярну адсорбцію можна представити за допомогою послідовних псевдохімічних реакцій:
A’ + B = A’B; A’B + B = A’B2; A’B2 + B = A’B3 і т.д. Константи рівноваги цих реакцій:
сAB = A1 – адсорбція в першому шарі молекул. сAB2 = A2– адсорбція в другому шарі молекул. сAB3 = A3– адсорбція в третьому шарі молекул. сB =р – концентрація (для газів парціальний тиск) адсорбату в об’ємі системи. сA =A0 - число вільних адсорбційних центрів. З виразів для константи рівноваги можна отримати рівняння, що виражають концентрацію відповідних комплексів на поверхні:
A1 = KAop A2 = K1A1p = KK1Aop2 A3 = K2A2p = KK1K2Aop3 (4.47) Згідно припущення теорії БЕТ всі шари на поверхні, крім першого, являють собою рідину. Тому взаємодія між молекулами така ж сама, як і при їх конденсації. K1 = K2 = K3 = …= KL (4.48) KL – константа конденсації пари. KL =ар/аг; ар = 1; аг = рs; KL = 1/ps (4.49)
ар, аг - активності компонентів рідкої та газової фази. Введемо наступні позначення: C = K/KL; x = p/ps (4.50) Стала С відповідає різниці енергій Гіббса процесів адсорбції і конденсації. -DG = RTlnC = RTlnK – RTlnKL (4.51) Загальна кількість активних центрів адсорбенту дорівнює: A∞ = Ao + A1 + A2 + A3 + … = Ao + AoCx + AoCx2+ AoCx3 = = Ao[1 + Cx(1+ x + x2 + …)] (4.52) В зв’язку з тим, що х<1: (1 + x + x2 + …) = 1/(1 – x) (4.53)
Величина адсорбції дорівнює кількості адсорбату, адсорбованого в усіх шарах: A = A1 + A2 + A3 + … = AoCx + 2AoCx2 + 3AoCx3 + … = = AoCx(1 + 2x + 3x2 + …) (4.55) При умові, що х<1: (1 + 2x + 3x2 + …) = 1/(1 – x)2 (4.56)
Підставимо в цей вираз рівняння (4.51), та замінимо х=p/ps отримуємо рівняння ізотерми адсорбції БЕТ.
Рівняння БЕТ добре застосовується в області тисків: 0,05< р/рS <0,3 При р/рS < 0,05 стає відчутним вплив неоднорідності поверхні. При р/рS >0,3 починається взаємодія між собою адсорбованих молекул. В області малих значень тисків р/рS<<1 рівняння ізотерми адсорбції БЕТ перетворюється на рівняння ізотерми адсорбції Ленгмюра:
Рис. 26. Ізотерма адсорбції БЕТ.
Вигляд ізотерми адсорбції БЕТ залежить від відношення констант рівноваги адсорбції та конденсації С. З ростом цього відношення зростає взаємодія між адсорбатом і адсорбентом і залежність адсорбції від тиску зростає більш стрімко (рис.26). З наближенням р до рS число вільних активних центрів зменшується, а кратність комплексів на поверхні зростає. При р=рS відбувається об’ємна конденсація пари. При обробці експериментальних даних рівняння БЕТ зручно використовувати в лінійній формі:
Лінійна форма рівняння дозволяє графічним методом визначити його константи А∞ і С.
Рис. 27. Ізотерма адсорбції БЕТ в лінійних координатах.
Приклад 4.3 При дослідженні адсорбції азоту на рутилі при 75К отримана прямолінійна залежність: (p/ps)/[A(1-p/ps)] = f(p/ps). Пряма відсікає на осі ординат відрізок b=0,027 (кг/моль), а тангенс кута її нахилу становить tgα = 2,610(кг/моль); Запишіть рівняння, яке описує дану ізотерму і розрахуйте константи рівняння та питому поверхню адсорбенту, якщо відомо, що площа, яку займає одна молекула азоту S0 = 0,16нм2. Адсорбція описується рівнянням БЕТ, яке в лінійній формі має вигляд:
(1/А∞С) = 0,027 (кг/моль); (С-1/ А∞С) = 2,61 (кг/моль);
Константи рівняння БЕТ дорівнюють: С = 97,7; А∞ = 37,9∙10-2 (моль/кг) Визначимо питому поверхню адсорбенту: Sпит = A∞NAS0 = 37,9∙10-2∙6,023∙1023∙16∙10-20 = 36,51∙103 (кг/м2)
|
||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 547; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.66.210 (0.009 с.) |



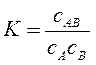 ;
;  ;
;  ;... (4.46)
;... (4.46) (4.54)
(4.54) (4.57)
(4.57) (4.58)
(4.58)

 (4.59)
(4.59)





