
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаємодія ВМС з розчинниками.
При взаємодії ВМС з розчинником відбувається поглинання низькомолекулярної сполуки полімером в результаті якого збільшується його об’єм і маса. Цей процес називають набряканням. Мірою його є ступінь набрякання: a = (m – mo)/mo (10.1) де mo, m - відповідно, маси вихідного і набряклого полімеру. ВМС можна розглядати як переохолоджену рідину. Процес її взаємодії з низькомолекулярною рідиною, можна представити, як процес взаємного розчинення двох рідин. Набрякання може бути обмеженим, або необмеженим. Обмежено набрякають полімери, що мають хімічні зв’язки (містки) між макромолекулами. Такі містки не дають макромолекулам відірватись одна від одної і перейти в розчин. Ланки макромолекул між містками можуть лише вигинатися, змінювати свою конформацію під дією молекул розчинника. Такі полімери тільки набрякають, але не розчиняються. Якщо полімери мають велику кількість містків і жорстку просторову сітку, то вони частково або зовсім не розчиняються і не набрякають. Так, вулканізований каучук обмежено набрякає в бензолі, а ебоніт - не розчиняється і не набрякає в ньому. За необмеженого набрякання в надлишку розчинника набряклі драглі полімеру самочинно переходять у розчин. В цьому випадку набрякання є початковою стадією розчинення. Специфіка набрякання полягає в тому, що взаємодіють різні за розмірами та рухливістю молекули. Перехід макромолекул у фазу розчинника відбувається дуже повільно. Молекули низькомолекулярних сполук (НМС) швидко проникають у сітку полімеру, розсувають ланцюги і збільшують його об’єм. Причиною набрякання є міжмолекулярна взаємодія, зумовлена сольватацією молекул. Набрякання завжди супроводжується виділенням теплоти і зменшенням загального об’єму системи. Полярні полімери набрякають в полярних рідинах (наприклад, білки у воді), неполярні - в неполярних (каучук в бензолі). Набрякання - самочинний процес який завжди відбувається зі зменшенням енергії Гіббса: DG=DH-TDS (10.2) Процес набрякання можна поділити на чотири стадії. В першій відбувається сольватація макромолекул ВМС. При цьому виділяється теплота: DН<0, DS=0. На другій стадії відбувається змішування молекул НМС і ВМС, при цьому молекули НМС проникають всередину ВМС. Молекули ВМС у фазу НМС ще не переходять.
На третій стадії спостерігається взаємне проникнення молекул обох сполук. Об’єм набряклого полімеру стає ще більшим. Теплота не виділяється (DН=0), зростає ентропія. Це пояснюється розпушуванням сітки і частковим вивільненням макромолекул. Підвищується число конформацій: TDS>0; DG=-TDS<0. На четвертій стадії система стає гомогенною. Якщо процес відбувається в чотири стадії, має місце необмежене набрякання. Якщо процес закінчується другою чи третьою стадією - це обмежене набрякання. В результаті обмеженого набрякання утворюються дві фази – насичений розчин полімеру в розчиннику та насичений розчин розчинника в полімері. Обмежено набухлий полімер називається драглями. Драглі схожі за своїми властивостями на гелі. Але вони утворені не вандерваальсовими, а хімічними або водневими зв’язками. Драглі можна розглядати як гомогенні системи. Якщо в процесі набрякання полімер помістити в жорстку оболонку, що пропускає молекули НМС, то на стінки цієї оболонки буде діяти сила, яка називається тиском набрякання. Він може досягати декількох десятків атмосфер. Його величину розраховують за емпіричним рівнянням Позняка: p=k∙Сn (10.3) де k і n – константи, що характеризують природу полімеру, та розчинника. С – вміст сухого полімеру в драглях. З підвищенням температури збільшується швидкість дифузії НМС, отже й швидкість набрякання. Швидкість та ступінь набрякання зростають із збільшенням ступеня подрібненості полімеру, тому що зростає поверхня контакту полімеру з розчинником й інтенсивність процесів дифузії молекул НМС. Самочинний процес поступового зменшення об’єму драглів і витіснення з них рідини (води), спочатку вільної, а в деяких випадках і зв’язаної називають синерезисом. Явище синерезису пояснюється прагненням нерівноважної системи досягнути стану рівноваги, в результаті чого зменшується об’єм драглів, але при цьому вони зберігають свою форму. Однією з характерних властивостей розчинів ВМС є застигання. Застигання - процес, зворотний набряканню. В основі цього процесу лежить виділення полімеру з його пересиченого розчину. Застигання розчинів ВМС спричиняється дією таких факторів, як зниженням температури, виведенням низькомолекулярної рідини, та введення електролітів.
Процес виділення окремих крапель ВМС з розчину називається коацервацією. Краплі ВМС мають сольватну оболонку з низькомолекулярної рідини. Вони здатні злипатися, не зливаючись між собою. Ці краплі називаються флокулами. Процес злипання флокул називається флокуляцією. Одним із основних факторів, що сприяє застиганню, є введення електролітів. Дія електролітів на розчини ВМС пояснюється рядом процесів. По-перше, це здатність електролітів утворювати місткові зв’язки в молекулах ВМС. По-друге, це - висолювання. Іони електроліту зменшують кількість вільної води, що припадає на молекули ВМС. Це викликає виділення ВМС із розчину, тобто відбувається драглеутворення. Даний процес виявляється у десольватації макромолекул і починається при значно більших концентраціях електроліту, ніж коагуляція в ліозолях. Висолююча дія електроліту зростає із збільшенням заряду та радіусу іонів. По-третє, це - вплив рН середовища, що властиво тільки для розчинів поліелектролітів. Поліелектроліти - це ВМС, які містять функціональні групи, що здатні до дисоціації. Вплив рН спостерігається і для амфотерних поліелектролітів, наприклад для білків. Білкові молекули мають кислотні (СООН-) та основні (-NH3) групи. Зменшення рН розчину стимулює дисоціацію основних груп і зумовлює появу на ланцюгу високополімеру надлишку позитивних зарядів. Електростатичне відштовхування цих зарядів спричиняє витягування ниткоподібної молекули. Ймовірність утворення асоціатів із випрямлених ниток вища, ніж із згорнутих у клубок. Таке покращення умов утворення асоціатів приводить до збільшення в’язкості та застигання. Аналогічна дія, і при збільшенні рН. Відмінність полягає лише в тому, що витягування макромолекул зумовлене електростатичним відштовхуванням. В обох випадках молекули білка переходять у фібрілярний стан. рН середовища, при якому ступінь дисоціації кислотної і лужної груп однаковий називають ізоелектричним. Описане явище грає важливу роль в життєдіяльності живих організмів. Зміна рН середовища порушує стан білків, що приводить до захворювань живих організмів.
Молекулярна маса ВМС
Одним із найважливіших параметрів ВМС є молекулярна маса. Як правило, ВМС складаються із суміші макромолекул з різними молекулярними масами. Тому для її характеристики використовують середні значення молекулярної маси: це середньочисельна Мn і середньомасова Мm молекулярні маси. Середньочисельна молекулярна маса показує середню масу, що припадає на одну частинку: Mn = Sni∙Mi/Sni (10.4) де ni - кількість макромолекул з молярною масою М. Середньомасова молекулярна маса показує відношення маси даної фракції до загальної маси ВМС: Mn = Smi∙Mi/Smi (10.5) де m- маса молекул з молярною масою M. Якщо ВМС має макромолекули одного розміру, то Мm = Мn. В інших випадках Мm>Мn, а їх співвідношення називається коефіцієнтом дисперсності. Методи визначення молекулярної маси ВМС поділяються на: Хімічні – пов’язані з визначенням кількості функціональних груп. Термодинамічні – зводяться до визначення мольної частки ВМС в розчині.
Молекулярно – кінетичні методи основані на явищах дифузії, ультрацентрифугування, та визначені в’язкості. Оптичні – основані на визначенні інтенсивності розсіювання світла. Віскозиметричні – основані на вимірювання в’язкості розчину ВМС. Розглянемо віскозиметричний метод визначення молекулярної маси ВМС. В’язкість розчинів ВМС набагато вища, ніж розчинів низькомолекулярних сполук з такою самою об’ємною концентрацією. Експериментальні дані показали, що питома в’язкість зростає з ростом молекулярної маси при сталих концентраціях. Штаудінгер запропонував залежність в’язкості розчину ВМС лінійної структури від молекулярної маси полімеру: hпит = К∙М∙с (10.6) де hпит - питома в’язкість; К - стала гомологічного ряду полімерів. hпит = (h - hо)/hо (10.7) де h, hо - відповідно, в’язкості розчину та розчинника. Питома в’язкість, віднесена до концентрації системи, називається зведеною в’язкістю hзв =hпит/с =КМ (10.8) Для розчинів ВМС зведена в’язкість hзв зростає із збільшенням концентрації. Це зростання зумовлене підсиленням взаємодії між макромолекулами. Екстраполюючи залежність в’язкості від концентрації (рис. 74) на вісь ординат, одержуємо характеристичну в’язкість: [h] = lim (hпит/c) (10.9) Характеристична в’язкість не залежить від концентрації розчину та конформаційного стану макромолекул. Залежність характеристичної в’язкості від молекулярної маси описується рівнянням Марка-Куна - Хаувінка: [h] = k∙Мa (10.10) де k - стала для гомологічного ряду полімерів. a - параметр, що характеризує форму макромолекули в розчині. Його значення змінюється в межах 0,55-0,85 та характеризує пружність ланцюгів макромолекули в розчині.
Рис. 74. Визначення характеристичної в’язкості розчину ВМС.
Коефіцієнти k і a визначають експериментально. За даними характеристичної в’язкості можна розрахувати середню молекулярну масу ВМС.
Приклад 10.1 Зразок синтетичного каучуку масою 0,17564 кг помістили в бензол. Через 24 години витримки при 25 °С маса цього зразка стала рівною 0,53921 кг Розрахуйте ступінь набухання зразка каучука в бензолі за вказаних умов. a = (0,53921 - 0,17564)/0,17564= 2,07 = 207 %. Приклад 10.2 Характеристична в'язкість розчину зразка синтетичного каучуку в толуолі при 20 °С дорівнює 4,62∙10-3 м3/моль. Розрахуйте середню молярну масу цього каучуку в умовах випробування. Сталі k і a рівняння Марка Куна Хаувінка прийняти рівними 5,14∙10-5 моль/м3 і 0,67.
Контрольні питання
1. Які властивості характерні ВМС? Як вони залежать від структури ВМС? 2. Як утворюються дисперсії полімерів? Наведіть приклади, охарактеризуйте їхні оптичні властивості. 3. Який процес називають набряканням? Що таке ступінь набрякання? 4. На які стадії можна полити процес набрякання? 5. Що таке тиск набрякання? Як його можна розрахувати? 6..Які системи називаються драглями. Наведіть приклади обмеженого і необмеженого набрякання драглів. Як впливає температура на процес набрякання драглів? 7. У чому проявляється старіння колоїдних систем? Що таке синерезис? 8. Що таке застигання полімерів? Які фактори сприяють застиганню? 9. Що таке середньочисельна та середньомасова молекулярні маси полімеру? 10. Охарактеризуйте властивості і практичне значення високомолекулярних іонітів. Наведіть приклади катіонітів і аніонітів. 11. Назвіть особливості поводження амфотерних високомолекулярних поліелектролітів у розчинах. Наведіть визначення ізоелектричного стану. 12. Наведіть способи визначення молекулярної маси полімерів. 13. Віскозиметричний метод визначення молекулярної маси ВМС. Рівняння Марка-Куна-Хаувінка.
|
||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 470; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.30.253 (0.024 с.) |

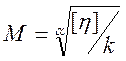 (10.11)
(10.11) кг/моль
кг/моль


