
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Получение гидроксида марганца (II)Содержание книги
Поиск на нашем сайте И изучение его свойств Выполнение опыта. В пробирку поместить 3‑4 капли 0,5 н раствора соли марганца (II), добавить 2‑3 капли 2 н раствора гидроксида натрия. Отметить цвет полученного осадка. Размешать стеклянной палочкой содержимое пробирки и оставить ее в штативе на 5‑10 мин. Наблюдать изменение цвета осадка, обусловленное переходом гидроксида марганца (II) в гидроксид марганца (IV). Написать уравнения реакций получения гидроксида марганца (II) и окисления его кислородом воздуха в присутствии воды. Опыт 2. Восстановительные свойства Соединений марганца (II) Выполнение опыта. Заполнить водой микроколбочку на 1/3 ее объема, добавить 3‑4 кристалла персульфата аммония (NH4)2S2O8 и по 2‑3 капли 2 н раствора азотной кислоты и нитрата серебра. Нагреть смесь почти до кипения и добавить 1 каплю раствора сульфата марганца (II). Наблюдать изменение окраски раствора. Написать уравнение реакции окисления Mn2+ персульфатом аммония в марганцовую кислоту, учитывая, что азотная кислота и нитрат серебра выполняют роль катализатора.
Опыт 3. Окислительно-восстановительные Свойства оксида марганца (IV) а) Окислительные свойства оксида марганца (IV) Выполнение опыта. Внести в пробирку 1 микрошпатель оксида марганца (IV) и 2‑3 капли концентрированной соляной кислоты (плотность 1,19 г/см3). Определить цвет и запах выделяющегося газа. Если реакция идет недостаточно энергично, пробирку слегка подогреть. Написать уравнение соответствующей реакции. Какой газ выделяется? б) Восстановительные свойства оксида марганца (IV) Выполнение опыта. В фарфоровый тигелек поместить небольшой кусочек твердого гидроксида натрия (брать пинцетом) и примерно столько же селитры (KNO3). Нагреть тигель на электроплитке до расплавления смеси. Не прекращая нагревания, добавить в расплав несколько крупинок оксида марганца (IV). Отметить изменение окраски расплава. Расплав сохранить для опыта 4. Написать уравнение реакции окисления оксида марганца (IV) нитратом калия в щелочной среде. Опыт 4. Окислительно-восстановительные свойства Манганатов (реакция диспропорционирования) Выполнение опыта. К расплаву, полученному в опыте 3б (после охлаждения), добавить воды, выдержать в течение 3‑4 мин. Отметить выпадение осадка и изменение цвета раствора. Написать уравнение реакции, учитывая, что происходит диспропорционирование манганата калия в водном растворе с образованием перманганата калия и оксида марганца (IV). В каком направлении сместится равновесие, если раствор подкислить уксусной кислотой?
Опыт 5. Окислительные свойства перманганатов а) Окисление пероксида водорода Выполнение опыта. В пробирку внести 3‑5 капель раствора перманганата калия и 2‑3 капли 2 н. раствора серной кислоты. Добавить 3‑4 капли 10 %‑ного раствора пероксида водорода. Отметить выделение газа и изменение окраски раствора. Какой газ выделяется? Как это можно доказать? Написать уравнение реакции. б) Окисление сульфата марганца (II) Выполнение опыта. В пробирку внести 3‑4 капли раствора перманганата калия и столько же раствора сульфата марганца (II). Определить реакцию среды синей лакмусовой бумажкой. Отметить внешние признаки реакции. Написать уравнение реакции, учитывая, что в результате образуется оксид марганца (IV).
Опыт 6. Влияние среды на окислительные Свойства перманганата Выполнение опыта. В три пробирки внести по 3‑4 капли раствора перманганата калия. В одну пробирку добавить 5‑6 капель 2 н. раствора серной кислоты, в другую – 3‑4 капли 2 н. раствора щелочи, в третью – 5‑6 капель воды. В каждую из пробирок добавить по 2‑4 капли раствора иодида калия. Раствор в третьей пробирке слегка подогреть. Отметить изменение окраски растворов. Чем обусловлено изменение окраски растворов? Написать уравнения соответствующих реакций, учитывая, что в щелочной среде иодид калия окисляется до иодата калия (KIO3), а в кислой и нейтральной – до свободного иода. Контрольные вопросы и задания 1. Охарактеризуйте валентные возможности d‑металлов подгруппы марганца. Приведите примеры характерных соединений. 2. Охарактеризуйте кислотно-основные свойства оксидов (II, III, IV, VI, VII), марганца. Напишите названия и схемы диссоциации соответствующих гидроксидов. 3. Охарактеризуйте окислительно-восстановительные свойства соединений марганца (II - VI). Приведите примеры соответствующих реакций. 4. Охарактеризуйте окислительно-восстановительные свойства соединений марганца (VII) в зависимости от реакции среды. Приведите примеры соответствующих реакций. 5. Выбрать правильные ответы из предложенных: I. Укажите какая из электронных формул соответствует иону марганца, проявляющему только окислительные свойства:
II. Укажите, какие продукты образуются при взаимодействии MnSO4 + (NH4)2S2O8 + H2O:
III. Укажите, какие соединения образуются при растворении нитрата марганца (II) в воде:
IV. Укажите, сколько электронов участвует в процессе окисления хлором манганата:
V. Укажите, какое название соответствует формуле Na2MnO3:
Элементы VIIIВ подгруппы
Железо (Fe), кобальт (Со) и никель (Ni) – d‑элементы семейства железа, их атомы имеют на внешнем уровне два электрона. Наиболее характерные степени окисления +2 и +3. В ряду напряжений Fe, Co, Ni находятся до водорода и вытесняют его из растворов кислот (подробно свойства элементов VIIIВ подруппы рассмотрены в разделе «Металлы» стр.101-102). В водных растворах соли этих элементов сильно гидролизованы. Например, соли Fe (III) ( 2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 3CO2 + 6NaCl. Окислительно–восстановительные свойства элементов VIIIВ подгруппы:
1. Восстановительные свойства атомов элементов:
2. Окислительно-восстановительная двойственность элементов в промежуточных степенях окисления. а) Э+3 – восстановитель:
2Fe+3(OH)3 + 10KOH + 3Br2 = 2K2Fe+6O4 + 6KBr + 8H2O
б) Э+3 – окислитель:
2Fe+3Cl3 + 2KI = 2Fe+2Cl2 + I2 + 2KCl.
3. Окислительные свойства элементов в высшей степени окисления:
Элементы VIIIВ подгруппы образуют большое количество комплексных соединений. Например, ионы Fe2+ и Fe3+ образуют прочные комплексные соли с ионами CN– – K4[Fe(CN)6] гексациано–II–феррат калия (желтая кровяная соль) и K3[Fe(CN)6] гексациано–III–феррат калия (красная кровяная соль), которые находят широкое применение в аналитической химии. Аналогичные комплексные соли образуют Co+2 и Co+3. Склонность к комплексообразованию у элементов VIIIВ подгруппы возрастает с ростом заряда ядра и увеличением степени окисления элемента (уменьшением ионного радиуса). Работа 12. Железо. Кобальт. Никель Приборы и реактивы: Пробирки. Штатив с пробирками. Спиртовка. Микрошпатель. Стеклянная палочка. Железо (стружка), соль Мора Растворы: соляной кислоты (2 н), серной кислоты (2 н, плотность 1,84 г/см3), азотной кислоты (2 н), перекиси водорода (3%), уксусной кислоты (2 н), гидроксида натрия (2 н), аммиака (25%), роданида аммония (или калия) (насыщенный, 0,01 н), сульфата кобальта (0,5 н), сульфата никеля (0,5 н), хлорида железа (III) (0,5 н), карбоната натрия (0,5 н), сльфида аммония (0,5 н), бихромата калия (0,5 н), перманганата калия (0,5 н), гесациано–III–феррата калия K3[Fe(CN)6] (0,5 н), иодида калия (0,5 н), гексациано–II–феррата калия K4[Fe(CN)6] (0,5 н), нитрата калия (0,5 н), диметилглиоксима (спиртовой), лакмуса (нейтральный).
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 883; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.96.255 (0.011 с.) |

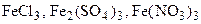 и др.) при взаимодействии с солями угольной кислоты (
и др.) при взаимодействии с солями угольной кислоты ( ) солей не образуют вследствие необратимого полного гидролиза
) солей не образуют вследствие необратимого полного гидролиза

 (Co+3, Ni+3 – только окислители)
(Co+3, Ni+3 – только окислители)

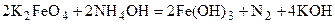
 . Сульфит натрия. Хлорид железа (II). Вода дистиллированная. Сероводородная вода. Хлорная вода.
. Сульфит натрия. Хлорид железа (II). Вода дистиллированная. Сероводородная вода. Хлорная вода.


