
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 10. Пассивирование (оксидирование) хрома
Выполнение опыта. Прикрепить маленький кусочек химически чистого хрома к стеклянной палочке парафином. Опустить палочку в пробирку с 10 каплями 2 н. раствора соляной кислоты и наблюдать энергичное растворение хрома. Перенести хром в пробирку, на 1/3 наполненную концентрированной азотной кислотой плотностью 1,4 г/см3. Через 1-2 мин промыть пассивированный хром дистиллированной водой и снова опустить в раствор соляной кислоты. Установить, происходит ли взаимодействие хрома с соляной кислотой в первый момент. Написать уравнения реакций взаимодействия хрома с соляной и азотной кислотами, учитывая, что азотная кислота образует на поверхности хрома коррозионно-стойкую пленку Сr2O3.
Контрольные вопросы и задания 1. Какие валентности наиболее характерны для хрома, молибдена и вольфрама? 2. Напишите уравнения диссоциации гидроксидов хрома (II, III и VI). 3. Напишите уравнения реакций гидролиза: а) сульфата хрома; б) хромита натрия; в) солей хрома (III) в присутствии соды и сульфида аммония. 4. Приведите примеры реакций, где хром (III) выступает в качестве восстановителя. 5. Приведите примеры реакций, где хром (VI) выступает в качестве окислителя. 6. Напишите схему равновесия между хромат- и бихромат- ионами. 7. Выбрать правильные ответы из предложенных: I. Какая степень окисления наиболее характерна для вольфрама:
II. Как хром реагирует с разбавленной серной кислотой:
III. Какие продукты образуются при взаимодействии хлорида хрома (III) с пероксидом водорода в щелочной среде:
Элементы VIIB подгруппы Марганец (Mn), технеций (Tc) и рений (Re) являются d‑элементами VIIВ подгруппы периодической системы. Их атомы имеют семь валентных электронов: два на s‑подуровне внешнего (n) энергетического уровня и пять – на d‑подуровне предвнешнего (n‑1) энергетического уровня: ns2(n‑1)d5. Металлические свойства ослабевают сверху вниз по подгруппе (т.е. от Mn к Re), что обусловлено значительным увеличением заряда ядра (25Mn, 43Tc, 75Re) и очень малым изменением радиуса (соответственно 1,30; 1,36; 1,37 В ряду напряжений марганец находится между Mg и Zn, в тонкодисперсном состоянии при нагревании может вытеснять водород из воды и растворов кислот (HCl, H2SO4) с образованием иона Mn2+. Например:
Mn + H2SO4(разб.) = MnSO4 + H2
Концентрированными серной и азотной кислотами марганец пассивируется и растворяется в них только при нагревании. Технеций и рений находятся в ряду напряжений после меди и окисляются только очень сильными окислителями (HNO3 или HClO4, а также KClO3 или KNO3 в щелочной среде) до ионов Например:
3Re + 7HNO3(конц.) = 3HReO4 + 7NO + 2H2O 8Tc + 7HClO4 + 4H2O = 8HTcO4 + 7HCl 6Re + 7KClO3 + 6KOH = 6KReO4 + 7KCl + 3H2O
Устойчивость соединений в высших степенях окисления возрастает от Mn к Re. Наиболее характерные степени окисления для марганца +2, +4, +6, +7, для технеция и рения +7. Соответственно марганец образует соединения основного (в степени окисления +2), амфотерного (+4) и кислотного (+6, +7) характера. Для технеция и рения характерны соединения кислотного характера. В степени окисления +2 марганец образует соединения основного характера. Гидроксид Mn(OH)2 под действием кислорода воздуха и воды постепенно окисляется до MnO2×xH2O. Ускорить процесс окисления Mn(II) до Mn(IV) можно действием более сильных окислителей в щелочной среде:
MnSO4 + Br2 + 4NaOH = MnO2 + 2NaBr + Na2SO4 + 2H2O
Диоксид MnO2 обладает амфотерным характером и при сплавлении со щелочами образует манганиты, соли несуществующей марганцеватистой кислоты MnO2 + 2NaOH
В водных растворах манганиты не существуют. При растворении в воде они гидролизуются с образованием MnO2. В степени окисления +6 марганец образует соединения марганцовистой кислоты – манганаты. Обычно они получаются при сплавлении диоксида MnO2 с окислителем в щелочной среде. Например:
MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O
В водных растворах манганаты, так же как и манганиты, неустойчивы. Однако их взаимодействие с водой сопровождается реакцией диспропорционирования:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH,
которая ускоряется при добавлении кислоты. В степени окисления +7 марганец, технеций и рений образуют соединения кислотного характера – перманганаты, пертехнаты и перренаты – соли соответственно марганцевой, технециевой и рениевой кислот.
Наиболее сильно выраженными окислительными свойствами обладают перманганаты. В зависимости от реакции среды они восстанавливаются по-разному:
Марганец используется в качестве легирующей добавки при получении высококачественных коррозионно-стойких инструментальных сплавов. В сочетании с молибденом и вольфрамом марганец и рений используются в производстве паст, которые применяются для изготовления коммутации и получения вакуумно-плотных спаев в корпусах на основе высокоглиноземистой керамики. Рений в виде сплава с платиной применяется для изготовления термоэлементов. Работа № 11. Марганец Приборы и реактивы: пробирки тугоплавкие, штатив и держатель для пробирок, стеклянные палочки, фарфоровые тигельки, наждачная бумага, фильтровальная бумага, стальные пластинки. Оксид марганца (IV), персульфат аммония: селитра (KNO3), гидроксид натрия, сульфит натрия, оксид свинца (IV), висмутат натрия, бромная вода. Растворы: нитрата (сульфата) марганца (II) (0,5 н), гидроксида натрия (2 н), азотной кислоты (2 н и d = 1,4 г/см3), соляной кислоты (d = 1,19 г/см3), серной кислоты (2 н), уксусной кислоты (2 н), сероводородной воды (свежеприготовленный), нитрата серебра (0,5 н), перманганата калия (0,5 н), сульфида аммония (0,5 н), пероксида водорода (10 %), нитрата серебра (0,5 н).
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 443; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.228.95 (0.012 с.) |
 ;
;
 ;
;
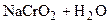 ;
;
 ;
;
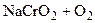 ?
?
 ).
).
 .
. Na2MnO3 + H2O
Na2MnO3 + H2O





