
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Б Синтез двойных и комплексных солей
Приборы и реактивы: технические весы с набором разновесов; водоструйные насосы с воронкой Бюхнера; кристаллизатор со льдом или снегом; пипетки (вместимостью 5, 10 мл); стаканы (вместимостью 10, 50, 100 мл); мерные цилиндры (на 10, 20 25 мл); стеклянные палочки; фильтровальная бумага; часовые стекла; сушильный шкаф; электроплитка; реактив Несслера, сухие соли: соли: сульфат меди, сульфат аммония, хлорид никеля; сульфат никеля, сульфат калия; растворы: аммиака (конц.), хлорида аммония (конц.), нитрата свинца (1 М), гексацианоферрата(III) калия K3[Fe(CN)6] (0,5 М); кобальтинитрита натрия, винной кислоты, гидротартрата натрия, диметилглиоксима, гидроксида натрия, 8-оксихинолина, хлорида бария, нитрата кальция, нитрата серебра, дифениламина (в концентрированной серной кислоте), ализарина; ацетатный буферный (рН = 5). Синтез двойных солей. Получить двойную соль согласно индивидуальному заданию. Рассчитать нужное количество компонентов по формуле соли и ее теоретический выход. Пример. Получить двойную соль сульфатов аммония и меди (NН4)2SO4·CuSO4·6Н2O, исходя из 1 г медного купороса CuSO4·5Н2O. Расчет. Для получения двойной соли (NН4)2SO4·CuSO4·6Н2O надо: на 1моль CuSO4·5Н2О взять 1моль(NH4)2SO4 и 1мольН2O, то есть на 249,68 г — // — нужно 132,13 г — // — и 18 г — //— Отсюда: Из таблицы растворимости солей видно, что при 373 К в 100 г раствора растворяется 50,8 г сульфата аммония. Для получения насыщенного раствора сульфата аммония навеску в 0,53 г (NH4)2SO4 следует растворить примерно в 1 мл кипящей воды. Теоретический выход соли. Из 1 моля CuSO4·5Н2О (М = 249,68) образуется 1 моль двойной соли (NH4)2SO4·CuSO4·6Н2О (М = 400). При использовании в синтезе навески CuSO4·5Н20 в 1 г теоретический выход соли будет равен
Отношение массы синтезированной соли к теоретическому выходу даст практический выход продукта. Выполнение опыта. Навеску медного купороса, взвешенную на технических весах, растворить при нагревании в 1 - 2 мл воды. Из рассчитанного количества сульфата аммония приготовить насыщенный при 373 К раствор. Слить горячие растворы сульфатов меди и аммония, перемешать стеклянной палочкой и поставить кристаллизоваться при 273 К. Выпавшие кристаллы рассмотреть под микроскопом и сравнить с кристаллами медного купороса. Определить, какие ионы находятся в растворе двойной соли. Для этого несколько кристаллов полученной соли растворить в воде и провести реакции на ионы NH4+, К+, Cu2+, SO42- и др.
Частные реакции на ионы Реакции NH4+-ионов 1. Реактив Несслера - раствор комплексной соли K2[HgI4] в КОН образует с растворами солей аммония характерный красно-бурый осадок:
Реактив Несслера содержит щелочь, из-за чего в присутствии ионов тяжелых металлов наблюдается выпадение гидроксидов этих металлов. Поэтому реакцию проводят следующим образом: к 2 - 3 каплям анализируемого раствора прибавляют избыток NaOH для осаждения гидроксидов металлов, затем, отцентрифугировав осадок, к отделенному от него центрифугату прибавляют реактив Несслера. 2. Едкие щелочи NaOH, КОН при нагревании выделяют из растворов соли аммония газообразный аммиак:
NaOH + NH4Cl ОН- + NH4+ ⇄ NH3↑ + Н2О
Поместить на часовое стекло 1 - 2 капли раствора соли аммония, 3 - 4 капли раствора щелочи и слегка нагреть. Выделяющийся аммиак можно обнаружить по запаху. Реакции К+ - ионов 1. Кобальтинитрит натрия Na3[Co(NO2)6] дает с растворами солей калия желтый осадок К2Na[Со(NO2)6]. К 1 капле Na3[Со(NO2)6] анализируемого раствора прибавить 1 - 2 капли реагента и перемешать. 2. Винная кислота Н2С4O6, и ее кислая соль - гидротартрат натрия NaHC4H4O6 - дают с растворами солей калия белый кристаллический осадок NaHC4H4O6. К 4 - 5 каплям анализируемого раствора прибавить такое же количество раствора NaHC4H4O6. Перемешать содержимое стеклянной палочкой и слегка потереть палочкой о стенки пробирки для ускорения образования осадка. Реакции Cu2+, Ni2+, Аl3+ - ионов 1. Едкие щелочи NaOH и КОН образуют с Cu2+ голубой осадок Cu(OH)2, чернеющий при нагревании. 2. Диметилглиоксим (реактив Чугаева) образует с Ni2+ внутрикомплексное соединение - осадок ярко-красного цвета. На 1 каплю раствора, содержащего Ni2+ подействовать 1 каплей реагента в присутствии 1 капли NH4OH. 3. 8-оксихинолин образует с ионами Al3+ в присутствии ацетатного буферного раствора (рН=5) зеленовато-желтый кристаллический осадок (C9H6NO)3Al. Реакции SO42–, Сl – и NO3– -ионов 1. Хлорид бария BaCl2 образует с ионом SO42 – белый осадок ВаSO4, нерастворимый в кислотах.
2. Микрокристпаллоскопическая реакция. К 1 капле исследуемого на SO42- раствора прибавить 1 каплю раствора Са(СН3СОО)2 или Ca(SO4)·2H2O и нагреть до появления каемки. Образуются кристаллы гипса CaSO4·2Н2O. 3. Нитрат серебра AgNO3 дает с Сl – белый творожистый осадок AgCl. 4. Дифениламин (C6H5)2NH является реагентом на NO3 – - ион. На тщательно вымытое и досуха вытертое часовое стекло поместить 1 каплю раствора дифениламина в концентрированной H2SO4. Туда же на кончике чистой стеклянной палочки внести немного испытуемого раствора нитрата и перемешать. В присутствии NO3 – появляется интенсивно синяя окраска вследствие окисления дифениламина образующейся азотной кислотой. Эту же реакцию дают ионы NO2 –, CrO42 – , MnO4 –, Fe3+ и другие окислители, имеющие достаточно высокий стандартный электродный потенциал.
Синтез комплексных солей Получить комплексную соль согласно индивидуальному заданию. Рассчитать, если требуется по заданию, нужное количество компонентов, теоретический выход продукта. Рассмотреть полученные кристаллы под микроскопом, провести качественный анализ на ионы. Взвесить полученную соль, определить выход продукта реакции в процентах. Сдать синтезированную соль лаборанту. Пример. Получить комплексную соль [Ni(NH3)6]Cl2, исходя из 1 г хлорида никеля NiC12. Расчет выхода соли. Из 129,6 г NiCI2 (1 моль) образуется 231,6 г [Ni(NH3)6]Cl2 (1 моль). Тогда из l г NiCI2 образуется то есть теоретический выход соли составляет 1,9 г. Выполнение опыта. Навеску исходной соли, взвешенную на технических весах, растворить в небольшом количестве дистиллированной воды. К раствору прибавить концентрированный раствор аммиака до полного растворения выпадающего осадка. Приготовить 20 мл аммиачного раствора хлорида аммония, для чего смешать 10 мл концентрированного аммиака с 10 мл концентрированного раствора NiCl2. Затем 12 мл этого раствора прибавить к ранее полученному. Дать отстояться образовавшемуся осадку, отфильтровать на воронке Бюхнера, осторожно промыть раствором хлорида аммония, а затем небольшим количеством этилового спирта. Высушить полученную соль в сушильном шкафу, взвесить и сдать лаборанту. Вычислить процент выхода соли. Задание 1 1. Получить двойную соль сульфатов аммония и меди (NH4)2SO4·CuSO4·6Н2О. Для этого 0,5 г медного купороса CuSO4·5Н,О взвесить на технических весах и растворить при нагревании в 2 - 3 мл воды. Из рассчитанного количества сульфата аммония приготовить насыщенный при 373К раствор (см. таблицу растворимости солей). Слить горячие растворы сульфатов меди и аммония, перемешать стеклянной палочкой и поставить кристаллизоваться при 0ºС. Выпавшие кристаллы отделить фильтрованием, рассмотреть под микроскопом и сравнить с кристаллами медного купороса. Провести качественный анализ на ионы. Для этого несколько кристаллов полученной соли растворить в воде и проделать качественные реакции на ионы NH4+, Cu2+, SO42-. 2. Ответить на следующие вопросы: • написать формулу аквасульфата тетраамминмеди(II), объяснить, на какие ионы эта соль диссоциирует в водном растворе; написать выражение константы нестойкости этой соли и привести ее численное значение; • с точки зрения метода валентных связей объяснить, какую форму имеют молекулы этого комплексного соединения;
• с точки зрения теории кристаллического поля рассчитать окраску этого комплексного соединения, если энергия расщепления Δ = 209 кДж·моль-1. Задание 2 1. Получить комплексную соль [Ni(NH3)6]Cl2. Для этого 5 г NiCI2, взвешенного на технических весах, растворить в 5 мл дистиллированной воды. К раствору прибавить концентрированный раствор аммиака до полного растворения выпадающего осадка. Приготовить 20 мл аммиачного раствора хлорида аммония, для чего смешать 10 мл концентрированного раствора аммиака с 10 мл концентрированного раствора NH4Cl; 12 мл этого раствора прибавить к ранее полученному раствору NiCI2. Дать осадку отстояться, отфильтровать его на воронке Бюхнера и осторожно промыть сначала приготовленным аммиачным раствором NH4Cl, а затем небольшим количеством этилового спирта. Высушить полученную соль фильтровальной бумагой, взвесить и сдать лаборанту. Вычислить процент выхода соли. 2. Ответить на следующие вопросы: • написать уравнение диссоциации этой комплексной соли; • написать выражение константы нестойкости комплексного иона и привести ее численное значение; • написать название комплексной соли и указать комплексообразователь, лиганды, координационное число, внутреннюю и внешнюю сферы; • с точки зрения метода валентных связей объяснить, какую форму имеет ион [Ni(NH3)6]2+, если известно, что он парамагнитен; • вычислить энергию расщепления d-подуровня комплексного иона [Cu(H2O)4]2+, если для него максимум поглощения видимого света соответствует длине волны 365 нм. Задание 3 1. Получить двойную соль сульфатов калия и меди К2SО4·CuSO4·6Н2О. Для этого 0,5 г медного купороса растворить при нагревании в 1 мл воды. Вычислить эквимолекулярное количество сульфата калия и приготовить насыщенный при 100ºС раствор. Слить горячие растворы меди и калия, перемешать стеклянной палочкой и поставить кристаллизоваться при 0ºС. Выпавшие кристаллы рассмотреть под микроскопом и сравнить с кристаллами медного купороса. Определить, какие ионы находятся в растворе. Для этого несколько кристаллов полученной соли растворить в воде и провести реакции на ионы К+, Cu2+, SO42-. 2. Ответить на следующие вопросы: • написать уравнение диссоциации синтезированной двойной соли; • написать формулу этой соли в виде комплексного соединения и дать название. Прочен ли этот комплекс? • дать название комплексной соли К4[Fe(CN)6], указать комплексообразователь, лиганды, координационное число, внутреннюю и внешнюю сферы, написать выражение для константы нестойкости соли и привести ее численное значение;
• указать тип гибридизации атомных орбиталей иона Fe2+ и пространственную форму иона [Fe(CN)6]4-, если известно, что он диамагнитен; • объяснить, почему ионы Cu+ бесцветны, а ионы Cu2+ окрашены. Задание 4 1. Получить комплексную соль [Cu(NH3)4]SO4·Н2О. Для этого 6 г медного купороса, взвешенного на технических весах, растворить в 10 мл дистиллированной воды. Нагреть до кипения, после чего при энергичном перемешивании стеклянной палочкой постепенно прибавить к нему концентрированный раствор аммиака до растворения выпавшего вначале осадка. Затем к полученному раствору при перемешивании прибавить небольшими порциями 5 мл этилового спирта. Выделившуюся соль отфильтровать через воронку Бюхнера, высушить фильтровальной бумагой, взвесить и сдать лаборанту. Вычислить процент выхода соли. Провести частные реакции на ионы Cu2+ и SO42-. 2. Ответить на следующие вопросы: • написать уравнение диссоциации синтезированного комплексногo соединения; • дать название комплексной соли; • написать выражение константы нестойкости; выписать из справочника ее численное значение; • с точки зрения метода валентных связей объяснить, какую форму имеет комплексный ион; • для комплексного иона [Cu(NH3)4]2+ полоса поглощения находится при 3040 А, а для [Cu(H2O)4]2+ - при 3650 А; определить, какова энергия электронных переходов и как изменяется сила поля лигандов при переходе от NH3 к Н2O. Задание 5 1. Получить двойную соль сульфата аммония и никеля (NН4)2SO4·NiSO4·6Н2O. Для этого приготовить два насыщенных при 80 ºС раствора, содержащих 0,7 г NiSO4·7Н2О и 0,32 г (NH4)2SO4 (взвесить на технических весах и растворить в 1 - 3 мл дистиллированной воды). Растворы слить, перемешать и охладить при 0 ºС. Выпавшие кристаллы рассмотреть под микроскопом и сравнить с кристаллами NiSO4·7H2O. Несколько кристаллов двойной соли растворить в воде и определить, какие ионы находятся в растворе (проделать частные реакции на ионы Ni2+, NH4+ и SO42-). 2. Ответить на следующие вопросы: • написать формулу синтезированной соли в виде комплексного соединения. Прочен ли этот комплекс? • дать название комплексной соли K2[Ni(CN)4], указать комплексообразователь, лиганды, координационное число, внутреннюю и внешнюю сферы; • написать уравнение диссоциации этой соли и выражение для константы нестойкости, привести ее численное значение; • определить тип гибридизации атомных орбиталей в ионе Ni2+ и пространственную структуру комплексного иона [Ni(CN)4]2- если известно, что он диамагнитен; • какова окраска соединений никеля (II) в водных растворах, если для иона [Ni(H2O)4]2+ энергия расщепления равна 180,6 кДж·моль-1? Задание 6 1. Получить комплексную соль Pb2[Fe(CN)6]NO3. Для этого к 10 мл 0,5 М раствора K3[Fe(CN)6] прибавить 15 мл 1 М раствора нитрата свинца и равный объем (25 мл) 50%-ного водного раствора ацетона. Смесь поместить для кристаллизации в снег. Кристаллы отфильтровать на воронке Бюхнера, высушить на фильтровальной бумаге и взвесить.
Рассчитать выход синтезированного вещества в процентах. Рассмотреть вид полученных кристаллов под микроскопом. Объяснить, для чего используется водный раствор ацетона. Испытать отношение полученного вещества к воде, разбавленной серной кислоте, раствору йодида калия. 2. Ответить на следующие вопросы: • написать уравнение диссоциации синтезированной соли, выражение константы нестойкости, привести ее численное значение; • написать название комплексной соли, указать комплексообразователь, лиганды, координационное число, внутреннею и внешнюю сферы; • с точки зрения метода валентных связей объяснить, диамагнитен или парамагнитен ион [Fe(CN)6]3-; • объяснить, почему соединения меди (I) не окрашены, а соединения меди (II) окрашены; • для комплексного иона [Fe(H2O)6]3+ энергия расщепления d-подуровня иона Fe3+ составляет 933,7 кДж·моль-1. При какой длине волны находится максимум поглощения видимого света этим ионом? Задание 7 1. Получить алюмоаммонийные квасцы. Для этого приготовить два горячих раствора, содержащих 1,0 г сульфата алюминия в 1,0 мл воды и 0,2 г сульфата аммония в 0,4 мл воды. Растворы соединить, перемешать и охладить до 0ºС. Выпавшие кристаллы отфильтровать и высушить на фильтровальной бумаге. Полученную двойную соль взвесить и вычислить выход в процентах. Рассмотреть полученные кристаллы под микроскопом. Часть кристаллов растворить в воде и провести частные реакции на составляющие соль ионы. 2. Ответить на следующие вопросы: • написать уравнение диссоциации синтезированной соли; • написать название комплексного соединения H[AuCl4]; • указать комплексообразователь, лиганды, координационное число, внутреннюю и внешнюю сферы, написать уравнение диссоциации этого соединения, выражение константы нестойкости, ее численное значение; • определить пространственную структуру иона [Со(Н2О)6]2+, если известно, что он диамагнитен; • для комплексного иона [Со(Н2О)6]2+ энергия расщепления d-подуровня Δ = 111,4 кДж·моль-1. Указать, при какой длине волны находится максимум поглощения видимого света ионом Со2+. Задание 8 1. Получить комплексную соль [Cu(NH3)4]SO4·Н2О. Для этого 8 г медного купороса растворить в 13 мл дистиллированной воды. Раствор нагреть до кипения, после чего при энергичном помешивании стеклянной палочкой прибавлять к нему концентрированный раствор аммиака, пока не растворится выпавший осадок. Затем к полученному раствору при перемешивании прибавить небольшими порциями 5 - 6 мл этилового спирта. Выделившуюся соль отфильтровать через воронку Бюхнера, высушить фильтровальной бумагой, взвесить и сдать лаборанту. Вычислить процент выхода соли. Изучить вид кристаллов под микроскопом, сравнить с кристаллами медного купороса. 2. Ответить на следующие вопросы: • написать уравнение диссоциации синтезированной соли; • привести выражение для константы нестойкости и ее численное значение; • написать название комплексной соли, указать комплексообразователь, лиганды, координационное число, внутреннюю и внешнюю сферы; • указать пространственную структуру иона [Cu(NH3)4]2+ (по методу Валентных сязей); объяснить его магнитные свойства; • определить, при какой длине волны будет находиться максимум поглощения видимого света ионом [CoF6]3-, если известно, что энергия расщепления d-подуровня Δ = 155,3 кДж·моль-1.
Контрольные вопросы и задания
1. Назовите следующие комплексные соединения: [Со(NH3)6]Сl3, [Со(NH3)5Н2О]Сl3, [Рt(ОН)2(NH3)4]Сl2, H4[Fe(CN)6], K2[Рt(NO2)2Сl2], K2[Co(NH3)2(NO2)4], [Pt(NH3)2Br4], [Pt(NH3)4][PtCl4], [Cu(NH3)2(CNS)2]. 2. Напишите координационные формулы следующих соединений: а) гексацианоферрат(II) железа(III); б) гексацианоферрат(III) калия; в) хлорид тетраммингидроксоплатины (IV); г) гексанитритокобальтат(III) натрия; д) тетранитритодиамминкобальтат(III) калия; е) тетрабромо-диамминплатина; ж) тетрамминфосфатохром. 3. Напишите уравнения диссоциации комплексной соли [Ag(NH3)2]NO3, выражение для Кнест. приведите все способы разрушения этой комплексной соли (Кнест. = 9·10-8). 4. Установите, в каких случаях произойдет взаимодействие между растворами нижеуказанных электролитов: а) K2[HgI4] + KBr; г) К[Аg(СN)2] + К2S2О3; б) K2[HgI4] + KCN; д) K[Ag(CN)2] + NH3; a) [Ag(NH3)2]Cl+ K2S2O3; е) K3[Сu(СN)4] + Нg(NО3)2. Напишите уравнения реакций в молекулярной и ионной форме. Металлы Рассмотрим свойства элементов следующих подгрупп: IB – Cu, Ag, Au IIB – Zn, Cd, Hg IIIA – В, Al, Ga, In, Tl VIIIВ – Fe, Со, Ni. Металлы этих подгрупп являются прекрасными проводниками (Cu, Ag, Au, Al, Fe) и составными компонентами полупроводников типов AIIВVI и AIIIBV и др. В побочных подгруппах химическая активность металлов увеличивается снизу вверх и первый элемент является наиболее активным. IB. Медь, серебро, золото В атомах металлов IB подгруппы электронная конфигурация внешнего и предшествующего уровней ns1(n-1)d10. В возбужденном состоянии они могут проявлять степени окисления соответственно +1, +2, +3: Ag+, Cu2+ (Cu+), Au3+(Au+). С неметаллами и аммиаком они взаимодействуют только при нагревании по следующим схемам:
Изменение химического характера оксидов и гидроксидов в зависимости от степени окисления представлено в табл.7.1.
Таблица 7.1 Характер оксидов и гидроксидов элементов IВ подгруппы
* Жирным шрифтом выделены формулы наиболее устойчивых оксидов.
Степень окисления +1 наиболее характерна для Ag, +2 - для Си, +3 - для Au. Гидроксид меди (II) Cu(OH)> - очень слабое основание, частично растворяется в концентрированных растворах сильных щелочей с образованием комплексных солей - тетрагидроксокупратов-(II):
Сu(ОН)2 + 2КОН = K2[Cu(ОН)4].
В большей степени выражена амфотерность для оксидов и гидроксидов золота (III): Au(ОН)3 + 3HCl = AuCl3 + 3Н2O Au(ОН)3 + KОН = K[Au(OH)4].
По последней реакции получаются тетрагидроксоаураты-(III). Медь, серебро, золото - прекрасные комплексообразователи, образуют самые разнообразные комплексные соединения: гидраты и аквакомплексы [Cu(Н2О)4]SO4, аммиакаты [Ag(NH3)2]NO3, тиосульфатные, роданидные, цианидные. Осадки AgCl, AgBr и другие легко растворяются в растворах аммиака, цианида и роданида калия, тиосульфата натрия вследствие комплексообразования. Например: AgCl+ 2NH3 = [Ag(NH3)2]Сl
Координационное число для Ag+, Au+, как правило, равно двум, для Cu2+, Au3+ - четырем. Растворы солей меди (II), образованных сильными кислотами, имеют вкислую реакцию среды за счет протекающего гидролиза:
Cu2+ + Н2О ⇄ CuOH+ + Н+ 2CuSO4 + 2Н2О ⇄ (CuОН)2SO4 + H2SO4.
Отношение этих металлов к кислотам определяется их положением в ряду напряжения. Так как они стоят после водорода, то растворяются лишь в сильных окислителях. Медь, серебро можно растворить в азотной (разбавленной и концентрированной) и серной (концентрированной) кислотах:
Cu + HNO3 = NO + Cu(NO3)2 + H2O разб. Cu + 4HNO3 = 2NO2 + Cu(NO3)2 + 2H2O конц. 2Ag + 2H2SO4 = Ag2SO4 + SO2 + 2H2O конц.
Золото растворяется в концентрированной селеновой кислоте H2SeO4, а также в царской водке (смесь конц. HNO3 + 3НСl) и в KCN в присутствии Н2O2 или О2 за счет комплексообразования
2Au+ 6H2SeO4 = Au2(SeO4)3 + 3SeO2 + 6Н2О конц. Au+ HNO3+ 4НСl = H[AuCl4]+ NО+ 2Н2О 4Au + 8KCN + O2 + 2Н2О = 4K[Au(CN)2] + 4КОН.
Ионы меди Сu2+, серебра Ag+ и золота Au3+ являются сильными окислителями: 2CuSO4 + 4KI = 2CuI↓ + I2 + 2K2SO4 2AgNO3 + 2NaOH + НСОН = 2Ag + НСООН + 2NaNO3 + H2O.
Последняя реакция применяется для получения пленок серебра (реакция серебряного зеркала).
IIB. Цинк, кадмий, ртуть Электронная конфигурация внешнего и предшествующего уровней атомов ns2(n-1)d10. Эти металлы могут проявлять степень окисления +2. Ртуть может иметь степень окисления +1. Например, в соединении Hg2Cl2 степень окисления ртути +1, а валентность равна 2, что отражено в структурной формуле Cl-Hg-Hg-Cl. Все они - типичные металлы, ртуть - единственный металл, жидкий при нормальных условиях. Если щелочноземельные металлы (IIA подгруппы) относятся к числу сильных восстановителей, то восстановительная активность металлов подгруппы цинка значительно ниже: цинк и кадмий – средние восстановители, а ртуть - слабый. Все три элемента легко образуют сплавы друг с другом и многими другими металлами. Сплавы с ртутью называются амальгамами. Способность к взаимодействию этих металлов с простыми веществами представлена схемой:
В ряду напряжений Zn и Cd находятся левее водорода, а Hg – значительно правее водорода. На воздухе цинк и кадмий покрываются тонким слоем оксида (или гидроксида), предохраняющим их от дальнейшей коррозии. Поэтому, несмотря на то, что эти элементы находятся в ряду напряжений левее водорода, они практически не вытесняют его из воды. Однако, если с них снять оксидную пленку, то они взаимодействуют с водой, выделяя водород:
Zn + 2H2O = Zn(OH)2 + H2
Цинк растворяется в щелочах с образованием цинкатов:
Zn + 2NaOH = Na2[Zn(OH)4] + H2
Растворение в щелочах характерно и для оксида и гидроксида цинка, благодаря их амфотерности. Оксиды и гидроксиды кадмия и ртути амфотерными свойствами не обладают и в щелочах не растворяются. В разбавленных растворах соляной и серной кислот цинк растворяется легко, кадмий медленно, а ртуть нерастворима. Азотная кислота легко растворяет все три металла, при этом выделяются различные оксиды азота. Особенность взаимодействия ртути с азотной кислотой состоит в том, что в зависимости от соотношения кислоты и металла могут получаться как соли окисной
Соли ртути (I) в водных растворах диссоциируют с образованием ионов [Hg2]2+:
Гидролиз солей цинка и его аналогов протекает ступенчато с образованием основных солей:
Поскольку гидроксид ртути неустойчив, основные соли ртути, образующиеся при гидролизе, содержат не группу
В окислительно–восстановительных реакциях Zn, Cd, Hg являются только восстановителями, ионы Э2+ - только окислителями, а ионы [Hg2]2+ могут проявлять окислительно-восстановительную двойственность: 1) Восстановительные свойства нейтральных атомов металлов:
2) окислительные свойства соединений элементов в высшей степени окисления: HgCl2 + SnCl2 + 2НСl = Н2[SnCl6] + Hg;
3) окислительно-восстановительная двойственность ионов [Hg2]2+:
Hg2I2 + 2KI = K2[HgI4] + Hg.
Цинк, кадмий, ртуть - хорошие комплексообразователи, образуют комплексные соединения с различными лигандами:
Zn(OH)2 + 4NН3 = [Zn(NH3)4](ОН)2.
Благодаря комплексообразованию можно растворить любые нерастворимые в воде соединения цинка, кадмия, ртути при подборе комплексообразующего растворителя. Так, осадок HgS (ПР = 1,6·10-52), растворимый лишь в царской водке, легко растворяется в смеси КI и НСl:
HgS + 4KI + 2НС1 = K2[HgI4] + Н2S + 2КСl.
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 664; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.185.147 (0.176 с.) |

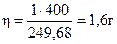


 NaCl + NH3↑ + Н2О
NaCl + NH3↑ + Н2О ,
,

 .
. (при избытке кислоты), так и закисной ртути
(при избытке кислоты), так и закисной ртути  (при избытке ртути), например:
(при избытке ртути), например:



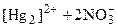 .
.



 , а ион кислорода:
, а ион кислорода:


 .
.




