
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторный практикум по курсуСодержание книги
Поиск на нашем сайте
"Неорганическая химия"
©МИЭТ, 2007 Элементы VIIA подгруппы Фтор, хлор, бром, йод, астат составляют VПА подгруппу, имеют конфигурацию внешнего уровня ns2p5 Астат получают искусственным путем, радиоактивен, период полураспада При обычных условиях молекулы галогенов двухатомны и существуют в виде Г2 (в отличие от элементов VIIB подгруппы). Растворимость галогенов в различных растворителях может быть хорошей иллюстрацией правила "подобное растворяется в подобном". Неполярные молекулы галогенов плохо растворяются в воде и хорошо - в неполярных органических растворителях (бензоле, толуоле, СС1 и др.). Способность хорошо растворяться в органических растворителях используют для извлечения галогенов из водных растворов методом экстракции. Химическая активность галогенов от фтора к йоду уменьшается. Так, фтор реагирует практически со всеми элементами при комнатной температуре (даже с золотом и платиной), для хлора некоторые реакций идут лишь при нагревании, для брома температура реакции должна быть еще выше, йод даже при сильном нагревании реагирует с ограниченным количеством элементов. Взаимодействие наиболее активных фтора и хлора с простыми и сложными веществами может быть представлено схемой:
Галогены - хорошие окислители. Уменьшение окислительной способности от фтора к иоду видно из окислительных потенциалов:
Значением окислительных потенциалов и различным сродством к электрону объясняется вытеснение одних галогенов другими из их соединений:
Например, Cl2 + 2KI = I2 + 2КСl, но I2 + КСl ≠ (реакция не идет).
Для быстрого связывания галогенов применяют тиосульфат натрия Na2S2O3:
Na2S2O3 + Cl2 + Н2О = Na2SO4 + S+ 2НСl,
с йодом образуется тетратионат натрия Na2S4O6:
2 Na2S2O3 + I2 = Na2S4O6 + 2NaI.
Галогеноводороды НГ хорошо растворяются в воде, водные растворы - сильные кислоты (кроме HF). Степень диссоциации а для 0,1 н. растворов составляет:
Плавиковая кислота относится к кислотам средней силы, так как в водном растворе ионы водорода частично связаны в ионы HF2-, Но HF- прекрасный комплексообразующий реагент, он входит в состав многих травителей для металлов и полупроводников, стекла, кремния и др. Ион F не бывает восстановителем; ион СГ может быть восстановителем лишь в концентрированных растворах соляной кислоты (NaCl не является восстановителем), а от Br к Г восстановительная способность возрастает; KI - один из наиболее распространенных восстановителей. В кислородных соединениях все галогены проявляют положительные степени окисления, кроме фтора. Так, хлор может проявлять положительные степени окисления +1, +3, +5, +7 (табл.l. 1).
Таблица 1.1 Кислородные соединения хлора
Для брома и йода степень окисления +7 не характерна, для них наиболее устойчива степень окисления +5:
3I2+ 10HNO3 = 6НIO3 + 10NO+ 2Н2О I2 + 5Сl2 + 6Н2О = 2НIO3 + 10НСl.
Многие соли кислородных кислот хлора обладают окислительно-восстановительной двойственностью, являются составными компонентами многих травителей полупроводников. Наибольшее применение находят гипохлориты и хлораты. Гипохлориты получают взаимодействием хлора с холодными щелочами:
Двойственную природу гипохлоритов (С+1) можно представить схемой:
NaClO+ MnSO4+ Н2О = NaCl + МnО2 + Н2SO4 окислитель 3KClO + 4KMnO4+ 2Н2О = 3KClO3 + 4МnО2 + 4КОН восстановитель
Хлораты получают пропусканием газообразного хлора в нагретые до 60 - 70ºС растворы щелочей: ЗCl2 + 6KOH = КСIО3 + 5КСl + 3Н2О
Для них, как и для гипохлоритов, характерна реакция диспропорциони-рования: 4КСlО3 = 3КСlO4 + KCI
Реакция протекает при умеренном нагревании. При сильном нагревании образующийся перхлорат разлагается с выделением кислорода:
КСlO4
Из кислородных соединений брома и йода наибольшее применение в качестве окислителей находят бромат и йодат калия. Они обладают меньшей окислительной способностью, чем хлораты:
КIО3+ 5КI+ 3Н2SO4 = 3I2+ 3К2SO4 + ЗН2О
Галогены и их соединения находят самое разнообразное применение. Из фтора получают фторопроизводные углеводородов с уникальными свойствами, например, тефлон, обладающий исключительной стойкостью к различным химическим реагентам, фреоны - охлаждающие жидкости. Жидкий фтор используется как один из самых эффективных окислителей в ракетном топливе. Для этих же целей применяются перхлораты аммония и калия (NH4ClO4, КСlO4). В микроэлектронике свободные галогены и их соединения находят широкое применение в качестве компонентов травителей полупроводников, в процессах фотолитографии (Сl2, Вг2, HF, НСl, HBr, HIO3, HClO, НСlO4 и др.). Легколетучие соединения (PCl3, РСl5, ВСl3 и др.) используются в качестве диффузантов для получения полупроводников простого и сложного составов заданного типа проводимости.
Работа №1 Галогены Приборы и реактивы: пробирки, тигель фарфоровый, электрическая плитка. Диоксид марганца, диоксид свинца, бихромат калия, хлорид натрия, бромид натрия, йодид натрия; порошки: магния, алюминия, цинка; органический растворитель, хлорная вода, бромная вода, йодная вода, сероводородная вода; растворы: хлорида натрия (0,5 н.), бромида натрия,. (0,5 н.), йодида калия (0,1 н.), нитрата серебра (0,1 н.), хлорида железа (Ш) (0,5 н.), сульфата марганца (0,5 н.), нитрата свинца (0,5 н.), перманганата калия (0,5 н.), тиосульфата натрия (0,5 н.), гидроксида натрия (2 н.), соляной кислоты (р = 1,19 г/см3), серной кислоты (р = 1,84 г/см3).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 217; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.184.92 (0.009 с.) |

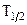 = 8,3 часа, поэтому он изучен недостаточно. Фтор проявляет единственную степень окисления — 1, остальные элементы могут распаривать свои электроны в пустые d-ячейки и проявлять дополнительно степени окисления +1, +3, +5, +7.
= 8,3 часа, поэтому он изучен недостаточно. Фтор проявляет единственную степень окисления — 1, остальные элементы могут распаривать свои электроны в пустые d-ячейки и проявлять дополнительно степени окисления +1, +3, +5, +7.



 Хлораты менее сильные окислители, чем гипохлориты, и тоже проявляют двойственность:
Хлораты менее сильные окислители, чем гипохлориты, и тоже проявляют двойственность: КСl + 2O2
КСl + 2O2


