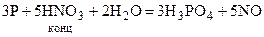Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хаханина Т.И., Никитина Н.Г., Гребенькова В.И., Шутова Р.Ф.Стр 1 из 21Следующая ⇒
Хаханина Т.И., Никитина Н.Г., Гребенькова В.И., Шутова Р.Ф.
Лабораторный практикум по курсу "Неорганическая химия".- М.: МИЭТ, 2007.
Приведены лабораторные работы по курсу "Неорганическая химия", дополненные примерами применения химических процессов как в микроэлектронике, так и для оценки экологической обстановки окружающей среды. Лабораторный практикум рекомендуется студентам факультета ЭТМО, специализирующихся в области «Инженерная защита окружающей среды», а также в области материалов и технологических процессов микроэлектроники.
Никитина Нина Георгиевна, Гребенькова Валентина Иосифовна, Хаханина Татьяна Ивановна, Шутова Раиса Фроловна.
Лабораторный практикум по курсу "Неорганическая химия"
©МИЭТ, 2007 Элементы VIIA подгруппы Фтор, хлор, бром, йод, астат составляют VПА подгруппу, имеют конфигурацию внешнего уровня ns2p5 Астат получают искусственным путем, радиоактивен, период полураспада При обычных условиях молекулы галогенов двухатомны и существуют в виде Г2 (в отличие от элементов VIIB подгруппы). Растворимость галогенов в различных растворителях может быть хорошей иллюстрацией правила "подобное растворяется в подобном". Неполярные молекулы галогенов плохо растворяются в воде и хорошо - в неполярных органических растворителях (бензоле, толуоле, СС1 и др.). Способность хорошо растворяться в органических растворителях используют для извлечения галогенов из водных растворов методом экстракции. Химическая активность галогенов от фтора к йоду уменьшается. Так, фтор реагирует практически со всеми элементами при комнатной температуре (даже с золотом и платиной), для хлора некоторые реакций идут лишь при нагревании, для брома температура реакции должна быть еще выше, йод даже при сильном нагревании реагирует с ограниченным количеством элементов. Взаимодействие наиболее активных фтора и хлора с простыми и сложными веществами может быть представлено схемой:
Галогены - хорошие окислители. Уменьшение окислительной способности от фтора к иоду видно из окислительных потенциалов:
Значением окислительных потенциалов и различным сродством к электрону объясняется вытеснение одних галогенов другими из их соединений:
Например, Cl2 + 2KI = I2 + 2КСl, но I2 + КСl ≠ (реакция не идет).
Для быстрого связывания галогенов применяют тиосульфат натрия Na2S2O3:
Na2S2O3 + Cl2 + Н2О = Na2SO4 + S+ 2НСl,
с йодом образуется тетратионат натрия Na2S4O6:
2 Na2S2O3 + I2 = Na2S4O6 + 2NaI.
Галогеноводороды НГ хорошо растворяются в воде, водные растворы - сильные кислоты (кроме HF). Степень диссоциации а для 0,1 н. растворов составляет:
Плавиковая кислота относится к кислотам средней силы, так как в водном растворе ионы водорода частично связаны в ионы HF2-, Но HF- прекрасный комплексообразующий реагент, он входит в состав многих травителей для металлов и полупроводников, стекла, кремния и др. Ион F не бывает восстановителем; ион СГ может быть восстановителем лишь в концентрированных растворах соляной кислоты (NaCl не является восстановителем), а от Br к Г восстановительная способность возрастает; KI - один из наиболее распространенных восстановителей. В кислородных соединениях все галогены проявляют положительные степени окисления, кроме фтора. Так, хлор может проявлять положительные степени окисления +1, +3, +5, +7 (табл.l. 1).
Таблица 1.1 Кислородные соединения хлора
Для брома и йода степень окисления +7 не характерна, для них наиболее устойчива степень окисления +5:
3I2+ 10HNO3 = 6НIO3 + 10NO+ 2Н2О I2 + 5Сl2 + 6Н2О = 2НIO3 + 10НСl.
Многие соли кислородных кислот хлора обладают окислительно-восстановительной двойственностью, являются составными компонентами многих травителей полупроводников. Наибольшее применение находят гипохлориты и хлораты.
Гипохлориты получают взаимодействием хлора с холодными щелочами:
Двойственную природу гипохлоритов (С+1) можно представить схемой:
NaClO+ MnSO4+ Н2О = NaCl + МnО2 + Н2SO4 окислитель 3KClO + 4KMnO4+ 2Н2О = 3KClO3 + 4МnО2 + 4КОН восстановитель
Хлораты получают пропусканием газообразного хлора в нагретые до 60 - 70ºС растворы щелочей: ЗCl2 + 6KOH = КСIО3 + 5КСl + 3Н2О
Для них, как и для гипохлоритов, характерна реакция диспропорциони-рования: 4КСlО3 = 3КСlO4 + KCI
Реакция протекает при умеренном нагревании. При сильном нагревании образующийся перхлорат разлагается с выделением кислорода:
КСlO4
Из кислородных соединений брома и йода наибольшее применение в качестве окислителей находят бромат и йодат калия. Они обладают меньшей окислительной способностью, чем хлораты:
КIО3+ 5КI+ 3Н2SO4 = 3I2+ 3К2SO4 + ЗН2О
Галогены и их соединения находят самое разнообразное применение. Из фтора получают фторопроизводные углеводородов с уникальными свойствами, например, тефлон, обладающий исключительной стойкостью к различным химическим реагентам, фреоны - охлаждающие жидкости. Жидкий фтор используется как один из самых эффективных окислителей в ракетном топливе. Для этих же целей применяются перхлораты аммония и калия (NH4ClO4, КСlO4). В микроэлектронике свободные галогены и их соединения находят широкое применение в качестве компонентов травителей полупроводников, в процессах фотолитографии (Сl2, Вг2, HF, НСl, HBr, HIO3, HClO, НСlO4 и др.). Легколетучие соединения (PCl3, РСl5, ВСl3 и др.) используются в качестве диффузантов для получения полупроводников простого и сложного составов заданного типа проводимости.
Работа №1 Галогены Приборы и реактивы: пробирки, тигель фарфоровый, электрическая плитка. Диоксид марганца, диоксид свинца, бихромат калия, хлорид натрия, бромид натрия, йодид натрия; порошки: магния, алюминия, цинка; органический растворитель, хлорная вода, бромная вода, йодная вода, сероводородная вода; растворы: хлорида натрия (0,5 н.), бромида натрия,. (0,5 н.), йодида калия (0,1 н.), нитрата серебра (0,1 н.), хлорида железа (Ш) (0,5 н.), сульфата марганца (0,5 н.), нитрата свинца (0,5 н.), перманганата калия (0,5 н.), тиосульфата натрия (0,5 н.), гидроксида натрия (2 н.), соляной кислоты (р = 1,19 г/см3), серной кислоты (р = 1,84 г/см3).
Опыт 2. Получение брома Выполнение опыта. В сухой пробирке смешать 2 - 3 кристаллика бромида натрия с равным количеством диоксида марганца. К смеси осторожно прибавить 2-3 капли серной кислоты (р = 1,84 г/см3). Отметить цвет выделяющихся паров свободного брома. (В пробирку после окончания опыта для связывания брома добавить раствор тиосульфата натрия.) Написать уравнение реакции получения брома.
Cвойств свободных галогенов Выполнение опыта. В одну пробирку внести 3 - 5 капель раствора бромида натрия, в две другие - по 3 - 5 капель раствора йодида калия. Во все три пробирки добавить по 2 - 3 капли органического растворителя. В первую и вторую пробирки внести по 3 - 4 капли хлорной воды, а в третью пробирку с раствором йодида калия - столько же бромной воды. Содержимое пробирок перемешать стеклянной палочкой и по окраске полученного слоя органического растворителя установить, какой галоген выделяется в свободном виде в каждой из пробирок.
Написать уравнения реакций в молекулярной и ионной форме. В каждом случае указать окислитель и восстановитель. Расположить галогены в ряд по убыванию их окислительной активности. Объяснить последовательность расположения галогенов в этом ряду. Могут ли свободные галогены являться восстановителями? Ответ обосновать.
Опыт 8. Хлораты и йодаты а) Окисление диоксида марганца хлоратом калия. Выполнение опыта. В тигелек поместить два микрошпателя хлората калия КСlO3 и кусочек твердого гидроксида натрия. Тигель поставить на плитку и нагревать до расплавления веществ. В расплавленную массу внести очень немного порошка МпО2, продолжая нагревание до появления зеленой окраски манганата калия К2МnO4. Написать уравнение реакции, учитывая, что хлорат калия переходит в хлорид калия. б) Окисление свободного йода хлоратом калия в кислой среде. Выполнение опыта. Поместить в пробирку 5 - 6 капель насыщенного раствора хлората калия КСlO3, прибавить 1 - 2 кристаллика йода и 1 - 2 капли концентрированной серной кислоты (ρ= 1,84 г/см3). Осторожно нагреть содержимое пробирки до кипения. Наблюдать за выделением газа. Подержать над отверстием пробирки йодокрахмальную бумажку. По запаху и действию выделяющегося газа на йодокрахмальную бумажку определить, какой газ выделяется. Доказать присутствие в растворе ионов ClO3–. Для этого по окончании выделения газа 2 - 3 капли полученного раствора внести в другую пробирку, добавить по 2 - 3 капли воды и раствора нитрата серебра. Наблюдать выпадение осадка йодата серебра. Написать уравнение реакции взаимодействия хлората калия с йодом, учитывая, что в результате реакции получается йодноватая кислота, а также уравнение реакции взаимодействия выделяющегося хлора с иодидом калия (йодокрахмальная бумажка). Объяснить результаты наблюдений. в) Окисление йодида калия йодатом калия. Выполнение опыта. В пробирку с 2 - 3 каплями раствора йодида калия прибавить 1 - 2 капли 2 н. раствора серной кислоты и по каплям добавлять раствор йодата калия KIO3 до изменения цвета раствора. На выделение какого вещества указывает бурая окраска? Написать уравнение реакции, составить электронно-ионный баланс, указать окислитель и восстановитель.
Контрольные вопросы и задания
1. Какие степени окисления характерны для элементов VII-А подгруппы? 2. Как изменяется окислительная способность свободных галогенов по группе? 3. Приведите примеры реакций, в которых свободный йод выступает как окислитель и как восстановитель. 4. Укажите лабораторные способы получения свободного хлора. 5. Какой из отрицательных ионов галогенов является наиболее сильным восстановителем? Ответ обоснуйте. 6. Почему хлорная вода обладает более сильными окислительными свойствами по сравнению с чистым хлором? 7. Перечислите кислородные кислоты галогенов. Как называются кислоты и соли? 8. Напишите формулы гипохлорита кальция, хлорита натрия, хлората серебра, перхлората аммония, хлорида висмута. Солями каких кислот они являются? 9. Как действует тиосульфат на свободные хлор, бром, йод? Приведите уравнения реакций. 10. Приведите примеры применения йодной и бромной воды для травления пленок благородных металлов в технологии изготовления интегральных схем. 11. Выбрать правильные ответы из предложенных: I. Укажите электронную формулу иона хлора (Cl–):
II. Укажите продукт окисления и продукт восстановления в следующей реакции:
III. Укажите, до какой степени окисления восстанавливается и окисляется йод в реакции
IV. Укажите, в какой степени окисления галогены проявляют только восстановительные свойства:
V. Укажите, какая из указанных реакций протекает наиболее интенсивно: а) б) в) г)
Элементы VIA подгруппы
Сера, селен и теллур - халькогены, элементы VIA подгруппы, относятся к р- электронному семейству. Их атомы имеют на внешнем уровне шесть электронов ns2np4. В ряду сера - селен - теллур с увеличением атомного радиуса неметаллические свойства ослабевают. Селен и теллур в стеклообразном состоянии обладают полупроводниковыми свойствами. Наиболее характерные степени окисления элементов: (- 2) - в соединениях с водородом, металлами; (+4, +6) - в соединениях с галогенами, кислородом (оксиды) и в их производных (гидроксиды, соли).
Например: а) S + Zn = ZnS б) S + 3F2 = SF6 S + Н2 = H2S S + Сl2 =SCl2 S + O2 = SO2 в) 3S+ 6КОН = K2SO3 + 2K2S+ 3Н2О.
Водородные соединения типа Н2Э (сероводород, селеноводород, теллуроводород) - бесцветные газы, очень ядовитые, с характерным неприятным запахом. Их водные растворы - слабые кислоты, для которых характерно усиление кислотных и восстановительных свойств в ряду Н2S → Н2Se → Н2Те. Поскольку эти кислоты двухосновные, им соответствуют два типа солей: средние Ме2Эх (сульфиды, селениды и теллуриды) и кислые Ме(НЭ)х (гидросульфиды, гидроселениды). Гидротеллуриды не получены. Наиболее применяемые из них - сероводород и сульфиды - прекрасные восстановители:
5H2S + 2КМnO4 + 3Н2SO4 = 5S↓ + 2МnSO4 + К2SO4 + 8Н2О.
Сульфиды всех металлов (кроме щелочных и щелочноземельных) - осадки. Сульфиды FeS, MnS, ZnS и некоторые другие (ПР≥1·10–25) растворяются в соляной кислоте, сульфиды CuS, PbS, CoS, Вi2S3, NiS (ПР<1·10–25) растворимы в азотной кислоте: 3CuS+ 8HNO3 = 3Cu(NO3)2 + 2NO+ 3S+ 4Н2O,
а сульфид ртути лишь в царской водке и других (смесь KI с НСl) комплексообразующих реагентах. Например:
HgS↓ + 4KI + 2НСl = К2[HgI4] + Н2S + 2КСl.
Сульфиды алюминия и хрома при взаимодействии с водой необратимо гидролизуются, образуя не растворимые в воде гидроксиды и сероводород:
Аl2S3 + 6Н2О = 2А1(ОН)3↓ + Н2S.
Оксиды и гидроксиды серы, селена, теллура обладают кислотным характером с ослаблением кислотных свойств в ряду S → Se → Те. Для серы известны следующие оксиды и соответствующие им кислоты:
Сульфоксиловая кислота в свободном состоянии не получена, но при взаимодействии монооксида серы SO с КОН получена соль К2SO2 - сульфоксилат калия. Практического применения они не имеют.
Например: а) Na2SO3 - окислитель:
Na2SO3 + 4KI + 3H2SO4 = S↓ + 2I2↓ + Na2SO4+ 2К2SO4+ 3Н2О;
б) Na2SO3 - восстановитель:
3Na2SO3+ К2Сr2О7 + 4H2SO4 = Сr2(SO4)3 + 3Na2SO4 + K2SO4 + 4Н2О.
Причем, функция окислителя для них менее характерна по сравнению с SeO32–и ТеO32–, для которых преобладают окислительные свойства. Серная и селеновая кислоты концентрированные являются окислителями (их соли окислительными свойствами не обладают).
Продукты восстановления S+6 в концентрированной Н2SO4 зависит от активности окисляемого элемента, его агрегатного состояния, температуры, концентрации кислоты. Разбавленные растворы этой кислоты реагируют только с металлами, стоящими в ряду напряжений до водорода, с восстановлением последнего в свободном состоянии. Окислителем в этом случае является катион водорода (Н+):
Zn + Н2SО4(разб.) = ZnSO4 + Н2↑, но 4Zn + 5H2SO4(конц.) S+ 2H2SO4(конц.) = 3SO2+ 2Н2О С + 2H2SO4(конц.) = СО2 + 2SO2 + 2Н2О.
Надкислоты. Для элементов группы VIА характерно образование надкислот. Отличительной особенностью этих соединений является наличие в их молекулах связи – О – О –, за счет разрыва которой они проявляют сильные окислительные свойства. Например, в надсерной (пероксодвусерной) кислоте Н2S2О8 (соли – персульфаты) распределение связей в молекуле может быть представлено в виде:
Ион
5K2S2O8 + 2 MnSO4 +H2O = 2HMnO4 + 5K2SO4 + 7H2SO4 Тиокислоты и тиосоли. Элементы группы VIА образуют тиокислоты и тиосоли. Например, тиосерная кислота Н2S2О3 образуется за счет замещения атома кислорода в молекуле серной кислоты атомом серы
Тиосерная кислота и соответствующие ей тиосульфаты неустойчивы и разлагаются самопроизвольно, особенно в присутствии окислителя, например:
Кислоты двухосновные и образуют два ряда солей: кислые (
Работа №2 Сера Приборы и реактивы: вытяжной шкаф, штатив, газоотводная трубка с пробкой, держатель для пробирок, микрошпатель, пипетка, спиртовка. Сульфид железа (II), сульфид калия, сульфит натрия, сульфит аммония, иодид калия (кристаллические). Растворы: азотной кислоты (2 н и плотностью 1,4 г/см3), серной кислоты (2 н и плотностью 1,84 г/см3), соляной кислоты (плотностью 1,19 г/см3), сернистой кислоты (2 н свежеприготовленный), хлорида натрия (0,5 н), хлорида кальция (0,5 н), хлорида железа (III) (0,5 н), хлорида бария (0,5 н), нитрата свинца (0,5 н), нитрата серебра (0,5 н), сульфата марганца (0,5 н), сульфата хрома (III) (0,5 н), сульфида аммония (0,5 н), тиосульфата натрия (0,5 н), персульфата аммония (0,5 н), сульфата меди (0,5 н), перманганата калия (0,5 н), бихромата калия (0,5 н), соли Мора (0,5 н свежеприготовленный), гидроксида натрия (2 н), лакмуса (нейтральный). Хлорная вода, бромная вода, дистиллированная вода, сероводородная вода (свежеприготовленная). Примечание: При выполнении работы необходимо помнить, что соединения селена и теллура ядовиты! Обращаться с ними нужно осторожно. При разбавлении концентрированной серной кислоты водой происходит выделение большого количества тепла вследствие гидратации, поэтому при получении разбавленных растворов необходимо кислоту тонкой струей приливать к воде при непрерывном помешивании.
Опыт 5. Гидролиз солей. Выполнение опыта. В три пробирки внести 8 ‑ 10 капель нейтрального раствора лакмуса. Одну пробирку оставить в качестве контрольной, во вторую добавить несколько кристалликов сульфида калия, в третью – сульфита калия. Отметить изменение окраски растворов в обеих пробирках по сравнению с контрольной. Объяснить причину изменения окраски растворов. Какую реакцию среды имеют растворы сульфида и сульфита калия? Используя табличные данные констант диссоциации соответствующих кислот, сделать вывод, в каком случае степень гидролиза соли должна быть больше. Халькогениды металлов Применение халькогенидов. В последние годы большое внимание уделяется изучению бинарных соединений типа А2В6, А4В6 (халькогениды цинка, кадмия, ртути, олова, свинца) и твердых растворов на их основе, так как они наряду с полупроводниками группы А3В5 относятся к важнейшим материалам полупроводниковой оптоэлектроники. Наиболее широко в промышленности используются сульфид цинка и сульфид кадмия при изготовлении люминофоров и фоторезистов. Помимо сульфида кадмия при производстве фоторезистов, чувствительных к видимому излучению, применяют спеченные порошкообразные соли и пленки селенида кадмия. Пленки селенида и теллурида ртути используют при изготовлении высокочувствительных датчиков Холла. Монокристаллы соединений А2В6 применяют в качестве рабочего тела полупроводниковых лазеров, возбуждаемого электронным лучом. Халькогениды свинца используют как детекторы ИК-излучения. Благодаря хорошим фотоэлектрическим характеристикам, их применяют в технологии фоторезистов. Особое внимание привлекают твердые растворы CdHg1-xТе, Pb1-xSnxTe при создании приемников ИК-излучения в области 8 - 14 мкм. Перспективно также применение Pb1-xSnxTe для инжекционных лазеров с излучением в спектральном диапазоне до 30 мкм. Необходимо отметить, что халькогениды других металлов тоже находят применение в электронной технике в качестве материалов с различным функциональным назначением. Свойства сульфидов. Сульфид-ионы образуют осадки практически со всеми ионами d-металлов. Большинство сульфидов металлов черного цвета, но есть сульфиды с характерной окраской. Так, ZnS белого цвета, MnS - розового, CdS - ярко-желтого (канареечного), Sb2S3 - оранжевого. Сульфиды некоторых металлов существуют в различных модификациях, различающихся растворимостью, цветом и структурой. Например, сульфид марганца розового цвета имеет ПР = 2,5·10-10, а его модификация зеленого цвета имеет ПР = 2,5·10-13; свежеосажденный осадок NiS уже при 20-минутном хранении переходит из относительно растворимой модификации а-NiS (ПР = 3,2·10-19) в менее растворимую β-NiS (IIP = 1·10-24) NiS (IIP = 2·10-26). Значения ПР сульфидов некоторых металлов представлены в табл.3.1.
Таблица 3.1 Растворители сульфидов
Химические методы получения полупроводниковых пленок халькогенидов металлов. В технологии полупроводниковых приборов на различные подложки наносят тонкопленочные структуры на основе бинарных соединений (ZnS, CdS, CdSe, PbS, PbSe, PbTe) и твердых растворов (ZnCd1-xS, CdSxSe1-x, CdxHg1-xТе, Рb1-xSnxTe). Наряду с физическими методами осаждения пленок, включающими вакуумное распыление, эпитаксиальное осаждение, катодное распыление и т.п., широко применяют химические методы. К ним относятся: 1) пульверизация с последующим пиролизом; 2) осаждение пленок из растворов; 3) реакции замещения; 4) электрохимическое осаждение и электрофорез. Рассмотрим первые два метода. Пульверизация с последующим пиролизом широко применяется для осаждения пленок сульфидов и селенидов. Раствор, содержащий растворимые соли компонентов осаждаемого соединения, распыляется на нагретую подложку. Капли распыленного раствора, достигнув поверхности горячей подложки, подвергаются пиролитическому разложению, а продукты реакций образуют на поверхности отдельные кристаллы, которые при нагревании создают на подложке сплошную пленку. Летучие побочные продукты реакции и избыток растворителя выделяются в виде пара. Таким образом получают пленки CdS и CdSe, обладающие высокими оптическими характеристиками. Для осаждения пленок CdS чаще используют разбавленный (от 0,001 до 0,1 М) водный раствор соли кадмия и соли сероорганического соединения. Обычно применяют CdCl2, и тиомочевину. Пленки CdS образуются по реакции CdCl2 + (NH2)2CS+ 2Н2О = CdS + 2NH4Cl + CO2.
Используют и другие соли кадмия: Cd(NO3)2, CdSO4, Cd(CH3COO)2. Тиомочевину можно заменить любым ее производным, например, N, N-диметилтиомочевиной N2(CH3)2H2CS, тиоуксусной кислотой СН3СОSН или роданидом аммония NH4CNS. При получении пленок селенидов вместо тиомочевины применяют селеномочевину или ее производные:
CdCl2 + (NH2)2СSe + 2Н2О = CdSe + 2NH4Cl+ СО2.
С помощью пиролитических реакций подобного типа осаждают также пленки сульфидов и селенидов ряда других металлов: Zn, Cu, In, Ag, Ga, Sb, Pb и Sn. Пленки теллуридов получить этим методом не удается, поскольку соли теллурорганических соединений крайне неустойчивы и их трудно синтезировать. Осаждение пленок из растворов впервые было применено при получении пленок, предназначенных для инфракрасной техники. В настоящее время этим методом получают многие двух- и многокомпонентные полупроводниковые пленки. Суть метода состоит в том, что если в растворе произведение концентраций ионов металла и сульфид-иона превышает произведение растворимости этого соединения, выпадает осадок. Чтобы формирующиеся пленки отличались высоким качеством, необходима низкая скорость процесса образования осадка. Для этого сульфид-ионы и ионы металла должны поступать в раствор малыми порциями. Такие условия создаются, если источником сульфид-ионов служит тиомочевина в щелочном растворе, а источником ионов металла - комплексные соединения металла. Растворение тиомочевины или ее производных в водном растворе щелочи протекает следующим образом:
(NH2)2CS + OH– = CH2N2 + H2O + HS–
Ионы металла образуются при диссоциации комплексных соединений этого металла (аммиачных, хлоридных, цианидных, гидроксокомплексов и др.). Диссоциация комплексного иона ничтожно мала и ионы металла, поступающие в раствор, удаляются из сферы реакции за счет образования осадка MeS, затем поступает новая порция ионов металла вследствие диссоциации, и процесс продолжается. Например, диссоциацию аммиачного комплекса кадмия можно описать уравнением [Cd(NH3)4]2+ ⇄ Cd2+ + 4NH3 и константой нестойкости
В реакционный стакан с подогревом и магнитной мешалкой для перемешивания раствора, заполненный реакционной смесью, вертикально подвешиваются подложки. В случае, когда произведение концентрации ионов больше произведения растворимости [Cd2+][S2-] > ПРCdS, на подложках осаждается пленка CdS. Аналогично получают пленки CdSe, PbSe, ZnS и др. Техника безопасности при выполнении работы. 1. Все работы с сульфидами следует проводить в вытяжном шкафу с опущенным стеклом. 2. Растворение осадков необходимо проводить под тягой, не вынося пробирки из-под вытяжного шкафа. 3. Все растворы после опытов следует сливать в специальную склянку под тягой.
Работа № 3 И исследование их свойств Приборы и реактивы: штатив для пробирок, водяная баня, магнитная мешалка, стакан на 500 мл, подложки стекла (меди или кремния). Растворы (0,5 н.): хлорида марганца; хлорида цинка; хлорида железа (II); хлорида кобальта; хлорида кадмия (0,5 н. и 10-2 М); хлорида висмута; нитрата свинца; хлорида сурьмы (Ш); хлорида олова (IV); хлорида ртути (II); сульфида натрия; пероксида водорода (конц.); йодида калия (0,1 н.); сероводородной воды; хромата калия (2 н.); тиомочевины (0,5 н. и 1 М); соляной кислоты (0,5 н.; 2 н. и конц.), азотной кислоты (конц.), гидроксида аммония (2 М).
Осадков сульфидов металлов Выполнение опыта 1. Осадки MnS, ZnS и FeS поочередно растворить в соляной кислоте, для чего часть осадка перенести в чистую пробирку и прибавить 3 - 5 капель 0,5 н. HCI. 2. Осадки CoS или NiS поочередно растворить в соляной кислоте в присутствии Н2O2 и в концентрированной HNO3 при нагревании, для чего часть осадка перенести в чистую пробирку и прибавить 2 капли 2 н. Нl и 2 капли Н2O2. К оставшейся части осадка добавить 2 - 3 капли концентрированной HNO3 и нагреть на водяной бане. 3. Один из осадков (CdS, Bi2S3 или PbS) растворить в концентрированной азотной кислоте, для чего в пробирку с осадком прибавить 2 – 3 капли HNO3. Осадки можно растворять и в разбавленной HNO3, в присутствии нескольких крупинок KNO2, каталитически ускоряющего реакцию. Наиболее растворимый из этих осадков CdS можно растворить при нагревании в 1 н НСl (образуется комплекс H2[CdCl4]). 4. Осадок HgS с наименьшей величиной ПР растворить: а) в царской водке или в смеси HCl + KI, для чего часть осадка HgS перенести в чистую пробирку и прибавить 1 каплю НNО3 (конц.) и 3 капли НС1 (конц.), б) к оставшейся части осадка HgS прибавить 3 капли НС1 (конц.) и 10 капель 0,1 н. раствора KI, перемешать до растворения осадка. 5. Один из осадков Sb2S3 или SnS2 растворить в избытке Na2S, для чего в пробирку с осадком добавить 10 - 12 капель Na2S, перемешать до растворения осадка с образованием тиосолей. 6. Результаты опытов записать в форму таблицы, составить уравнения методом ионно- электронного баланса.
Форма таблицы Результаты опытов
Опыт 3 (контрольная задача). Элементы VА подгруппы Азот и фосфор являются элементами VА подгруппы периодической системы Д.И.Менделеева. Они относятся к р‑электронному семейству. На внешнем энергетическом уровне их атомов находится пять электронов ns2np3. В нормальном состоянии они проявляют валентность, равную трем. Окислительные числа азота и фосфора в различных соединениях изменяются от ‑3 до +5. Азот и фосфор с водородом и кислородом образуют соединения со слабо-полярными ковалентными связями, поэтому в водных растворах они не образуют ни элементарных катионов (подобных Al3+), ни элементарных анионов (подобных S2-). Азот образует молекулы N2 с тройными связями и является химически инертным. При обычной температуре он реагирует только с литием, образуя нитрид Li3N, с остальными веществами он реагирует только при повышенных температурах. Фосфор в свободном состоянии существует в виде нескольких аллотропних модификаций (белый, красный, черный). Он легко соединяется с кислородом (белый воспламеняется), галогенами, серой, металлами. С водородом фосфор непосредственно не соединяется. Соответствующее водородное соединение фосфин получается косвенным путем из фосфидов: Mg3P2 + 6HCl = 3MgCl2 + 2PH3 Фосфор окисляется концентрированной азотной кислотой до ортофосфорной кислоты:
При действии щелочи он диспропорционирует с образованием фосфина и гипофосфита: 4P + 3NaOH + 3H2O = PH3 + 3NaH2PO2
С водородом азот и фосфор образуют летучие соединения ЭH3.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 317; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.72.78 (0.186 с.) |
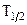 = 8,3 часа, поэтому он изучен недостаточно. Фтор проявляет единственную степень окисления — 1, остальные элементы могут распаривать свои электроны в пустые d-ячейки и проявлять дополнительно степени окисления +1, +3, +5, +7.
= 8,3 часа, поэтому он изучен недостаточно. Фтор проявляет единственную степень окисления — 1, остальные элементы могут распаривать свои электроны в пустые d-ячейки и проявлять дополнительно степени окисления +1, +3, +5, +7.



 Хлораты менее сильные окислители, чем гипохлориты, и тоже проявляют двойственность:
Хлораты менее сильные окислители, чем гипохлориты, и тоже проявляют двойственность: КСl + 2O2
КСl + 2O2




 и
и 
 и
и 

 и
и 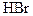




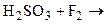
 Сера и ее аналоги могут участвовать в реакциях окисления (а), восстановления (б), диспропорционирования (в) по схеме:
Сера и ее аналоги могут участвовать в реакциях окисления (а), восстановления (б), диспропорционирования (в) по схеме: Сернистая кислота и ее соли - сульфиты - обладают окислительно-восстановительной двойственностью:
Сернистая кислота и ее соли - сульфиты - обладают окислительно-восстановительной двойственностью: Восстановление концентрированной Н2SO4 металлами и неметаллами можно представить схемой:
Восстановление концентрированной Н2SO4 металлами и неметаллами можно представить схемой: 4ZnSO4 + H2S + 4H2O
4ZnSO4 + H2S + 4H2O
 , будучи окислителем, претерпевает следующее превращение:
, будучи окислителем, претерпевает следующее превращение:



 ,
, 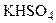 ) и средние (
) и средние ( ,
,  ). Водные растворы солей слабых кислот
). Водные растворы солей слабых кислот  и
и 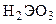 и сильных оснований имеют щелочную реакцию среды вследствие гидролиза:
и сильных оснований имеют щелочную реакцию среды вследствие гидролиза:


 .
.