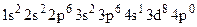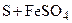Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 6. Качественное определение ионов серы.
а) Определение сульфид–ионов ( Выполнение опыта. В пробирку внести по 2 ‑ 3 капли растворов сульфата кадмия и сульфида натрия. Отметить образование характерного ярко–желтого осадка. Убедиться в растворимости осадка в разбавленной азотной кислоте. Написать уравнения реакций взаимодействия сульфата кадмия с сульфидом натрия и сульфида кадмия с разбавленной азотной кислотой, учитывая, что последняя окисляет б) Определение сульфит–ионов ( Выполнение опыта. В пробирку внести 5 – 6 капель раствора сульфита натрия (свежеприготовленного) и 2 ‑ 3 капли 2 н раствора серной кислоты. Отметить выделение газа с характерным запахом горящей серы. Написать уравнение реакции взаимодействия сульфита натрия с серной кислотой. Какой газ выделяется? в) Определение тиосульфат–ионов ( Выполнение опыта. В пробирку внести 8 – 10 капель раствора нитрата серебра и 1 ‑ 2 капли раствора тиосульфата натрия. Отметить образование белого осадка, который быстро темнеет (особенно при нагревании) вследствие превращения тиосульфата серебра в сульфид. Написать уравнения реакций взаимодействия тиосульфата натрия с избытком нитрата серебра и разложения тиосульфата серебра. г) Определение сульфат ионов ( Выполнение опыта. В пробирку внести 3 ‑ 4 капли раствора сульфата натрия и 2 ‑ 3 капли раствора хлорида бария. Отметить выпадение белого осадка. Проверить осадок на растворимость в кислотах. Написать уравнения соответствующих реакций. Контрольные вопросы и задания 1. Напишите ионные и молекулярные уравнения реакций гидролиза сульфида и сульфита натрия. Добавлением каких веществ можно предотвратить гидролиз? 2. Напишите уравнения реакций растворения: а) кальция – в концентрированном растворе серной кислоты, б) железа – в разбавленном растворе серной кислоты. Составьте ионно–электронный баланс. 3. Какими способами можно из сульфата натрия получить серную кислоту, серу, сероводород, тиосульфат натрия? Приведите примеры уравнений реакций. 4. Можно ли для осушения сероводорода и йодоводорода применять концентрированную серную кислоту? Ответ обоснуйте.
5. Напишите уравнения реакций растворения магния в разбавленном и концентрированном растворах селеновой кислоты. 6. Напишите ионные и молекулярные уравнения реакций растворения сульфида цинка в серной кислоте и селенида железа (II) в соляной кислоте. 7. Напишите уравнение реакции взаимодействия золота с концентрированной селеновой кислотой. 8. Выберите правильные ответы из предложенных: I. Укажите электронную формулу селена в степени окисления (–2): а) б) в) г) д) II. Укажите, какие вещества образуются при взаимодействии серы с концентрированной азотной кислотой:
III. Укажите соединение теллура, проявляющее только окислительные свойства:
IV. Укажите продукты реакции, образующиеся при нагревании концентрированной серной кислоты с железом:
V. Укажите продукты гидролиза сульфида калия:
Халькогениды металлов Применение халькогенидов. В последние годы большое внимание уделяется изучению бинарных соединений типа А2В6, А4В6 (халькогениды цинка, кадмия, ртути, олова, свинца) и твердых растворов на их основе, так как они наряду с полупроводниками группы А3В5 относятся к важнейшим материалам полупроводниковой оптоэлектроники. Наиболее широко в промышленности используются сульфид цинка и сульфид кадмия при изготовлении люминофоров и фоторезистов. Помимо сульфида кадмия при производстве фоторезистов, чувствительных к видимому излучению, применяют спеченные порошкообразные соли и пленки селенида кадмия. Пленки селенида и теллурида ртути используют при изготовлении высокочувствительных датчиков Холла. Монокристаллы соединений А2В6 применяют в качестве рабочего тела полупроводниковых лазеров, возбуждаемого электронным лучом. Халькогениды свинца используют как детекторы ИК-излучения. Благодаря хорошим фотоэлектрическим характеристикам, их применяют в технологии фоторезистов. Особое внимание привлекают твердые растворы CdHg1-xТе, Pb1-xSnxTe при создании приемников ИК-излучения в области 8 - 14 мкм. Перспективно также применение Pb1-xSnxTe для инжекционных лазеров с излучением в спектральном диапазоне до 30 мкм. Необходимо отметить, что халькогениды других металлов тоже находят применение в электронной технике в качестве материалов с различным функциональным назначением.
Свойства сульфидов. Сульфид-ионы образуют осадки практически со всеми ионами d-металлов. Большинство сульфидов металлов черного цвета, но есть сульфиды с характерной окраской. Так, ZnS белого цвета, MnS - розового, CdS - ярко-желтого (канареечного), Sb2S3 - оранжевого. Сульфиды некоторых металлов существуют в различных модификациях, различающихся растворимостью, цветом и структурой. Например, сульфид марганца розового цвета имеет ПР = 2,5·10-10, а его модификация зеленого цвета имеет ПР = 2,5·10-13; свежеосажденный осадок NiS уже при 20-минутном хранении переходит из относительно растворимой модификации а-NiS (ПР = 3,2·10-19) в менее растворимую β-NiS (IIP = 1·10-24) NiS (IIP = 2·10-26). Значения ПР сульфидов некоторых металлов представлены в табл.3.1.
Таблица 3.1
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 304; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.188.64 (0.008 с.) |
 ) в растворах
) в растворах ) в растворах
) в растворах ) в растворах
) в растворах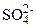 ) в растворах
) в растворах