
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Восстановительных свойств галогенид-ионов
а) Восстановление серной кислоты. Выполнение опыта. В одну пробирку поместить кристаллик бромида натрия, в другую - йодида калия и добавить к ним по 2 - 3 капли серной кислоты (р = 1,84 г/см3). Наблюдать выделение дыма в обеих пробирках в первый момент (влажные HBr и HI). Отметить окраску выделяющихся паров брома и йода и появление запаха сернистого газа в первой пробирке и сероводорода - во второй. Написать уравнения реакций получения бромо- и йодоводорода и последующего окисления их серной кислотой. Бромоводород восстанавливает серную кислоту до SO2, йодоводород - до SO2, S и Н2S. Объяснить различную восстановительную способность галогеноводородов. б) Восстановление хлорида железа (III). Выполнение опыта. В одну пробирку внести 3 - 4 капли раствора йодида калия, в другую - столько же раствора бромида натрия. В обе пробирки добавить по 3 - 4 капли какого-либо органического растворителя и по 1 - 2 капли раствора хлорида железа (Ш). Отметить результат в каждой пробирке. В каком случае произошло восстановление хлорида железа (Ш)? Написать уравнение протекающей реакции. Чем объяснить различную восстановительную способность отрицательных ионов галогенов? Привести электронные структуры ионов галогенов и расположить в порядке возрастания восстановительной активности. Могут ли отрицательные ионы галогенов проявлять окислительные свойства? Ответ обосновать.
Опыт 7. Гипохлориты и их окислительные свойства а) Получение гипохлорита натрия. Выполнение опыта. В коническую пробирку внести 10 - 15 капель 2 н. раствора гидроксида натрия и поместить ее в стакан с холодной водой. В цилиндрическую пробирку, снабженную пробкой с отводной трубкой, поместить 2 - 3 кристаллика КМnO4, 1 - 2 капли воды и 3 - 4 капли концентрированной HCl (ρ = 1,19 г/см3). Пробирку укрепить в штативе, опустить конец отводной трубки в коническую пробирку с раствором гидроксида натрия и пропускать через раствор выделяющийся из цилиндрической пробирки хлор в течение 2 - 3 мин. Если выделение хлора протекает недостаточно энергично, цилиндрическую пробирку слегка подогреть. Написать уравнения реакций получения хлора при взаимодействии KMnO4 с концентрированной НСl, а также взаимодействия хлора с холодным гидроксидом натрия. Учесть, что при этом, кроме гипохлорита натрия, получается хлорид натрия. Составить электронно-ионный баланс.
Полученный раствор использовать в опытах 76 и 7в. б) Окисление сульфата марганца гипохлоритом натрия. Выполнение опыта. В пробирку внести 3 - 4 капли раствора сульфата марганца и добавить к нему 2 - 3 капли полученного в опыте 7а раствора гипохлорита натрия. Отметить выделение осадка диоксида марганца. Написать уравнение реакции, учитывая, что гипохлорит натрия переходит в хлорид натрия. в) Восстановление перманганата калия гипохлоритом натрия. Выполнение опыта. В пробирку внести 1 - 2 капли KMnО4 и добавить 2 - 3 капли раствора гипохлорита натрия, полученного в опыте 7а. Отметить выделение осадка диоксида марганца. Написать уравнение реакции, учитывая, что гипохлорит натрия переходит в хлорат натрия. Какую функцию в этом опыте выполняет гипохлорит натрия? Составить электронно-ионный баланс.
Опыт 8. Хлораты и йодаты а) Окисление диоксида марганца хлоратом калия. Выполнение опыта. В тигелек поместить два микрошпателя хлората калия КСlO3 и кусочек твердого гидроксида натрия. Тигель поставить на плитку и нагревать до расплавления веществ. В расплавленную массу внести очень немного порошка МпО2, продолжая нагревание до появления зеленой окраски манганата калия К2МnO4. Написать уравнение реакции, учитывая, что хлорат калия переходит в хлорид калия. б) Окисление свободного йода хлоратом калия в кислой среде. Выполнение опыта. Поместить в пробирку 5 - 6 капель насыщенного раствора хлората калия КСlO3, прибавить 1 - 2 кристаллика йода и 1 - 2 капли концентрированной серной кислоты (ρ= 1,84 г/см3). Осторожно нагреть содержимое пробирки до кипения. Наблюдать за выделением газа. Подержать над отверстием пробирки йодокрахмальную бумажку. По запаху и действию выделяющегося газа на йодокрахмальную бумажку определить, какой газ выделяется. Доказать присутствие в растворе ионов ClO3–. Для этого по окончании выделения газа 2 - 3 капли полученного раствора внести в другую пробирку, добавить по 2 - 3 капли воды и раствора нитрата серебра. Наблюдать выпадение осадка йодата серебра.
Написать уравнение реакции взаимодействия хлората калия с йодом, учитывая, что в результате реакции получается йодноватая кислота, а также уравнение реакции взаимодействия выделяющегося хлора с иодидом калия (йодокрахмальная бумажка). Объяснить результаты наблюдений. в) Окисление йодида калия йодатом калия. Выполнение опыта. В пробирку с 2 - 3 каплями раствора йодида калия прибавить 1 - 2 капли 2 н. раствора серной кислоты и по каплям добавлять раствор йодата калия KIO3 до изменения цвета раствора. На выделение какого вещества указывает бурая окраска? Написать уравнение реакции, составить электронно-ионный баланс, указать окислитель и восстановитель.
Контрольные вопросы и задания
1. Какие степени окисления характерны для элементов VII-А подгруппы? 2. Как изменяется окислительная способность свободных галогенов по группе? 3. Приведите примеры реакций, в которых свободный йод выступает как окислитель и как восстановитель. 4. Укажите лабораторные способы получения свободного хлора. 5. Какой из отрицательных ионов галогенов является наиболее сильным восстановителем? Ответ обоснуйте. 6. Почему хлорная вода обладает более сильными окислительными свойствами по сравнению с чистым хлором? 7. Перечислите кислородные кислоты галогенов. Как называются кислоты и соли? 8. Напишите формулы гипохлорита кальция, хлорита натрия, хлората серебра, перхлората аммония, хлорида висмута. Солями каких кислот они являются? 9. Как действует тиосульфат на свободные хлор, бром, йод? Приведите уравнения реакций. 10. Приведите примеры применения йодной и бромной воды для травления пленок благородных металлов в технологии изготовления интегральных схем. 11. Выбрать правильные ответы из предложенных: I. Укажите электронную формулу иона хлора (Cl–):
II. Укажите продукт окисления и продукт восстановления в следующей реакции:
III. Укажите, до какой степени окисления восстанавливается и окисляется йод в реакции
IV. Укажите, в какой степени окисления галогены проявляют только восстановительные свойства:
V. Укажите, какая из указанных реакций протекает наиболее интенсивно: а) б) в) г)
Элементы VIA подгруппы
Сера, селен и теллур - халькогены, элементы VIA подгруппы, относятся к р- электронному семейству. Их атомы имеют на внешнем уровне шесть электронов ns2np4. В ряду сера - селен - теллур с увеличением атомного радиуса неметаллические свойства ослабевают. Селен и теллур в стеклообразном состоянии обладают полупроводниковыми свойствами. Наиболее характерные степени окисления элементов: (- 2) - в соединениях с водородом, металлами; (+4, +6) - в соединениях с галогенами, кислородом (оксиды) и в их производных (гидроксиды, соли).
Например: а) S + Zn = ZnS б) S + 3F2 = SF6 S + Н2 = H2S S + Сl2 =SCl2 S + O2 = SO2 в) 3S+ 6КОН = K2SO3 + 2K2S+ 3Н2О.
Водородные соединения типа Н2Э (сероводород, селеноводород, теллуроводород) - бесцветные газы, очень ядовитые, с характерным неприятным запахом. Их водные растворы - слабые кислоты, для которых характерно усиление кислотных и восстановительных свойств в ряду Н2S → Н2Se → Н2Те. Поскольку эти кислоты двухосновные, им соответствуют два типа солей: средние Ме2Эх (сульфиды, селениды и теллуриды) и кислые Ме(НЭ)х (гидросульфиды, гидроселениды). Гидротеллуриды не получены. Наиболее применяемые из них - сероводород и сульфиды - прекрасные восстановители:
5H2S + 2КМnO4 + 3Н2SO4 = 5S↓ + 2МnSO4 + К2SO4 + 8Н2О.
Сульфиды всех металлов (кроме щелочных и щелочноземельных) - осадки. Сульфиды FeS, MnS, ZnS и некоторые другие (ПР≥1·10–25) растворяются в соляной кислоте, сульфиды CuS, PbS, CoS, Вi2S3, NiS (ПР<1·10–25) растворимы в азотной кислоте: 3CuS+ 8HNO3 = 3Cu(NO3)2 + 2NO+ 3S+ 4Н2O,
а сульфид ртути лишь в царской водке и других (смесь KI с НСl) комплексообразующих реагентах. Например:
HgS↓ + 4KI + 2НСl = К2[HgI4] + Н2S + 2КСl.
Сульфиды алюминия и хрома при взаимодействии с водой необратимо гидролизуются, образуя не растворимые в воде гидроксиды и сероводород:
Аl2S3 + 6Н2О = 2А1(ОН)3↓ + Н2S.
Оксиды и гидроксиды серы, селена, теллура обладают кислотным характером с ослаблением кислотных свойств в ряду S → Se → Те. Для серы известны следующие оксиды и соответствующие им кислоты:
Сульфоксиловая кислота в свободном состоянии не получена, но при взаимодействии монооксида серы SO с КОН получена соль К2SO2 - сульфоксилат калия. Практического применения они не имеют.
Например: а) Na2SO3 - окислитель:
Na2SO3 + 4KI + 3H2SO4 = S↓ + 2I2↓ + Na2SO4+ 2К2SO4+ 3Н2О;
б) Na2SO3 - восстановитель:
3Na2SO3+ К2Сr2О7 + 4H2SO4 = Сr2(SO4)3 + 3Na2SO4 + K2SO4 + 4Н2О.
Причем, функция окислителя для них менее характерна по сравнению с SeO32–и ТеO32–, для которых преобладают окислительные свойства. Серная и селеновая кислоты концентрированные являются окислителями (их соли окислительными свойствами не обладают).
Продукты восстановления S+6 в концентрированной Н2SO4 зависит от активности окисляемого элемента, его агрегатного состояния, температуры, концентрации кислоты. Разбавленные растворы этой кислоты реагируют только с металлами, стоящими в ряду напряжений до водорода, с восстановлением последнего в свободном состоянии. Окислителем в этом случае является катион водорода (Н+):
Zn + Н2SО4(разб.) = ZnSO4 + Н2↑, но 4Zn + 5H2SO4(конц.) S+ 2H2SO4(конц.) = 3SO2+ 2Н2О С + 2H2SO4(конц.) = СО2 + 2SO2 + 2Н2О.
Надкислоты. Для элементов группы VIА характерно образование надкислот. Отличительной особенностью этих соединений является наличие в их молекулах связи – О – О –, за счет разрыва которой они проявляют сильные окислительные свойства. Например, в надсерной (пероксодвусерной) кислоте Н2S2О8 (соли – персульфаты) распределение связей в молекуле может быть представлено в виде:
Ион
5K2S2O8 + 2 MnSO4 +H2O = 2HMnO4 + 5K2SO4 + 7H2SO4 Тиокислоты и тиосоли. Элементы группы VIА образуют тиокислоты и тиосоли. Например, тиосерная кислота Н2S2О3 образуется за счет замещения атома кислорода в молекуле серной кислоты атомом серы
Тиосерная кислота и соответствующие ей тиосульфаты неустойчивы и разлагаются самопроизвольно, особенно в присутствии окислителя, например:
Кислоты двухосновные и образуют два ряда солей: кислые (
Работа №2 Сера Приборы и реактивы: вытяжной шкаф, штатив, газоотводная трубка с пробкой, держатель для пробирок, микрошпатель, пипетка, спиртовка. Сульфид железа (II), сульфид калия, сульфит натрия, сульфит аммония, иодид калия (кристаллические). Растворы: азотной кислоты (2 н и плотностью 1,4 г/см3), серной кислоты (2 н и плотностью 1,84 г/см3), соляной кислоты (плотностью 1,19 г/см3), сернистой кислоты (2 н свежеприготовленный), хлорида натрия (0,5 н), хлорида кальция (0,5 н), хлорида железа (III) (0,5 н), хлорида бария (0,5 н), нитрата свинца (0,5 н), нитрата серебра (0,5 н), сульфата марганца (0,5 н), сульфата хрома (III) (0,5 н), сульфида аммония (0,5 н), тиосульфата натрия (0,5 н), персульфата аммония (0,5 н), сульфата меди (0,5 н), перманганата калия (0,5 н), бихромата калия (0,5 н), соли Мора (0,5 н свежеприготовленный), гидроксида натрия (2 н), лакмуса (нейтральный). Хлорная вода, бромная вода, дистиллированная вода, сероводородная вода (свежеприготовленная). Примечание: При выполнении работы необходимо помнить, что соединения селена и теллура ядовиты! Обращаться с ними нужно осторожно. При разбавлении концентрированной серной кислоты водой происходит выделение большого количества тепла вследствие гидратации, поэтому при получении разбавленных растворов необходимо кислоту тонкой струей приливать к воде при непрерывном помешивании.
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1074; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.102.239 (0.047 с.) |




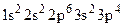

 и
и 
 и
и 

 и
и 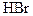




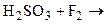
 Сера и ее аналоги могут участвовать в реакциях окисления (а), восстановления (б), диспропорционирования (в) по схеме:
Сера и ее аналоги могут участвовать в реакциях окисления (а), восстановления (б), диспропорционирования (в) по схеме: Сернистая кислота и ее соли - сульфиты - обладают окислительно-восстановительной двойственностью:
Сернистая кислота и ее соли - сульфиты - обладают окислительно-восстановительной двойственностью: Восстановление концентрированной Н2SO4 металлами и неметаллами можно представить схемой:
Восстановление концентрированной Н2SO4 металлами и неметаллами можно представить схемой: 4ZnSO4 + H2S + 4H2O
4ZnSO4 + H2S + 4H2O
 , будучи окислителем, претерпевает следующее превращение:
, будучи окислителем, претерпевает следующее превращение:



 ,
, 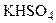 ) и средние (
) и средние ( ,
,  ). Водные растворы солей слабых кислот
). Водные растворы солей слабых кислот  и
и 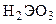 и сильных оснований имеют щелочную реакцию среды вследствие гидролиза:
и сильных оснований имеют щелочную реакцию среды вследствие гидролиза:





