
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коферменты, простетические группы. Роль витаминов, металлов и других кофакторов в функционировании ферментов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Ферменты – специфические высокоэффективные катализаторы белковой природы, способные увеличивать скорость химических реакций, протекающих в живой клетке, в миллионы и миллиарды раз. Ферменты – всегда глобулярные белки. Холофермент (молекула ф-та): апофермент (белковая ч-ть) и кофактор (небелк. ч-ть), к-ый может прочно связываться с белк ч-тью (простетич. группа кальций, железо, купрум) и легко отсоединяться (кофермент) (геммы, нуклеотиды). Многие ферментативные реакции включают перенос электронов или групп атомов с одного субстрата на другой. В таких реакциях всегда принимают участие вспомогательные соединения (коферменты), которые выполняют функцию промежуточных переносчиков атомов или функциональных групп. Ферменты обычно высокоспецифичны к своим субстратам, коферменты же взаимодействуют со многими ферментами, обладающими различной субстратной специфичностью. По способам взаимодействия с ферментом различают растворимые коферменты и простатические группы. Растворимый кофермент присоединяется во время реакции к молекуле фермента подобно субстрату, химически изменяется и затем снова освобождается. Первоначальная форма кофермента регенерируется во второй, независимой реакции. Простетической группой наз-ся кофермент, который прочно связан с ферментом и во время реакции его не покидает. Группа, связавшаяся с коферментом, далее переносится на следующий субстрат или другую молекулу кофермента. Простетические группы могут быть органическими (витамины, углеводы, липиды) или неорганическими (например, ионы металлов). Белок без простетической группы называется «апобелок», а белок с присоединенной группой — «холобелок» (или, соответственно, в случае ферментов — апофермент и холофермент). Активирующее влияние на скорость ферментативной реакции оказывают разнообразные вещества органической и неорганической природы. Так, соляная кислота активирует действие пепсина желудочного сока; желчные кислоты повышают активность панкреатической липазы; некоторые тканевые ферменты (оксидоредуктазы, катепсины, аргиназа), растительная протеиназа и др. в значительной степени активируются соединениями, содержащими свободные SH-группы (глутатион, цистеин), а ряд ферментов – также витамином С. Особенно часто активаторами выступают ионы двухвалентных и, реже, одновалентных металлов. Получены доказательства, что около четверти всех известных ферментов для проявления полной каталитической активности нуждаются в присутствии металлов. Многие ферменты вообще не активны в отсутствие металлов. Так, при удалении цинка угольная ангидраза (карбоангидраза), катализирующая биосинтез и распад Н2СО3, практически теряет свою ферментативную активность; более того, цинк при этом не может быть заменен никаким другим металлом. Известны ферменты, действие которых активируется ионами нескольких металлов; в частности, енолаза активируется Mg2+, Mn2+, К+.
20. Основные представления о кинетике ферментативных процессов. Зависимость скорости реакции от концентрации субстрата. Уравнение Михаэлиса-Ментен. Константа Михаэлиса. В простейшем случае ур-ние р-ции с участием фермента имеет вид: E+S-->ES-->E+P где E - фермент, S - субстрат, ES - фермент-субстратный комплекс (т. наз. комплекс Михаэлиса), P- продукт р-ции.
Одним из характерных проявлений жизни является удивительная способность живых организмов кинетически регулировать химические реакции, подавляя стремление к достижению термодинамического равновесия. Ферментативная кинетика занимается исследованием закономерностей влияния химической природы реагирующих веществ (ферментов, субстратов) и условий их взаимодействия (концентрация, рН среды, температуры, присутствие активаторов или ингибиторов) на скорость ферментативной реакции. Главной целью изучения кинетики ферментативных реакций является получение информации, которая может способствовать выяснению молекулярного механизма действия фермента. Общие принципы кинетики химических реакций применимы и к ферментативным реакциям. Известно, что любая химическая реакция характеризуется константой термодинамического равновесия (уравнение Михаэлиса-Ментен). На скорость ферментативной р-ии влияют: конц-ия субстрата температура: существуют оптимальные значения, при которых фермент наиболее активен рН среды: обусловливает степень ионизации аминокислотных групп и суммарный заряд белка, что, в свою очередь определяет конформацию молекулы.
21.Специфичность действия ферментов. Влияние различных факторов среды на ферментативные процессы (температура, концентрации водородных ионов и др.). Ферменты обладают высокой специфичностью действия. Высокая специфичность ферментов обусловлена конформационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими «узнавание», высокое сродство и избирательность протекания одной какой-либо реакции из тысячи других химических реакций, осуществляющихся одновременно в живых клетках. В зависимости от механизма действия различают ферменты с относительной (или групповой) и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Например, пепсин в одинаковой степени расщепляет белки животного и растительного происхождения, несмотря на то что эти белки существенно отличаются друг от друга как по химическому строению и аминокислотному составу, так и по физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы, ни жиры. Объясняется это тем, что точкой приложения, местом действия пепсина является пептидная —СО—NH-связь. Абсолютной специфичностью действия называют способность фермента катализировать превращение только единственного субстрата. Любые изменения (модификации) в структуре субстрата делают его недоступным для действия фермента. Примерами таких ферментов могут служить аргиназа, расщепляющая в естественных условиях (в организме) аргинин, уреаза, катализирующая распад мочевины, и др. Стереоспецифичность – высокая избирательная способность фермента взаимодействовать с одним оптическим изомером (D-,L -ряда). Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной реакции, подобно влиянию температуры на любую хим р-ю. С повышением температуры ускоряется движение мл-л, что приводит к повышению вероятности взаимодействия реагирующих вещ-в. Кроме того, температура может повышать энергию реагирующих мол-л, что также приводит к ускорению р-ии. Однако скорость хим р-ии, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности, возникающим из-за термической денатурации белковой мол-лы. Для большинства ферментов чел-ка оптимальна температура 37-38 °С. Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. Например, при закислении среды происходит протонирование свободных аминогрупп (NH3+), а при защелачивании происходит отщепление протона от карбоксильных групп (СОО-). Это приводит к изменению конформации молекулы фермента и конформации активного центра; следовательно, нарушается присоединение субстрата, кофакторов и коферментов к активному центру. Оптимум: пепсин (1,5-2), каталаза (6,8-7) и тд. При увеличении количества субстрата начальная скорость возрастает. Когда фермент становится полностью насыщенным субстратом, т.е. происходит максимально возможное при данной концентрации фермента формирование фермент-субстратного комплекса, наблюдают наибольшую скорость образования продукта. Дальнейшее повышение концентрации субстрата не приводит к увеличению образования продукта, т.е. скорость реакции не возрастает. Таким образом, концентрация фермента - лимитирующий фактор в образовании продукта.
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 935; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.72.244 (0.012 с.) |


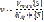 Км – константа Михаэлиса.
Км – константа Михаэлиса.


