Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
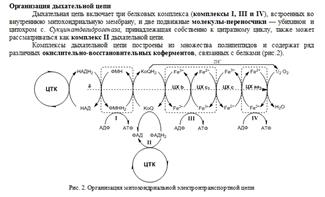
Цепь переноса водорода и электронов (дыхательная цепь).
Окисление субстратов в процессе дыхания можно представить как перенос электронов и протонов (т.е. в целом – атомов водорода) от органических веществ на кислород. На каждом этапе выделяется АТФ. Водород от первичных доноров вводится в дыхательную цепь с участием НАД-зависимых и ФАД-зависимых дегидрогеназ. ФАД-зависимые дегидрогеназы переносят водород на убихинон (образуется убихинон QH2), а НАД-зависимые дегидрогеназы – на НАД (образуется НАД*Н). Далее с НАД+Н водород передается тоже на убихинон. Затем в дыхательной цепи пути электронов и протонов расходятся. Перенос электронов осуществляется с помощью цитохромов (гемопротеины). В организме человека в результате тканевого дыхания образуется 300-400 мл воды за сутки (метаболическая вода).
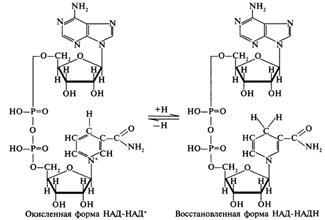
50. НАД и НАДФ-зависимые дегидрогеназы. НАД и НАДФ — широко распространённые в природе коферменты некоторых дегидрогеназ — ферментов, катализирующих окислительно-восстановительные реакции в живых клетках. Они принимают на себя водород и электроны окисляемого соединения и передают их на другие вещества. Дегидрогеназы - это оксидоредуктазы, катализирующие процесс отщепления атомов водорода. Все дегидрогеназы являются холоферментами, коферментами которых служат следующие соединения: никотинамидаденинди-нуклеотид (НАД), никотинамидадениндинуклеотид (НАДФ), флавинмононуклеотид (ФМН), флавинадениндинуклеотид (ФАД), хиноны. Наиболее распространены в природе дегидрогеназы, содержащие в качестве кофермента НАД. Эти ферменты катализируют реакции окисления веществ путем дегидрирования (дегидрирование гидроксильных групп, альдегидных групп, аминогрупп): при этом окисляемое вещество служит донором водорода, а НАД выполняет роль акцептора водорода, т.е. восстанавливается. Остаток никотинамида в молекуле НАД принимает непосредственное участие в реакции. Примером процесса, катализируемого НАД-зависимой дегидрогеназой, может служить окисление молочной кислоты (лактата) до пировиноградной кислоты (пирувата): см рис. Такого же типа реакции катализируют дегидрогеназы, использующие в качестве кофермента никотинамидадениндинуклеотидфосфат (НАДФ). Этот кофермент отличается от НАД только наличием дополнительного фосфатного остатка. Однако биологические функции НАД и НАДФ различны. Например НАДФ-зависимая малатдегидрогеназа локализована в цитозоле клетки, в отличии от митохондриальной НАД-зависимой малатдегидрогеназы. В отличии от НАД*Н НАДФ*Н не может передавать водород в дыхательную цепь: водород НАДФ*Н используется в восстановительных реакциях. При восстановительных синтезах энергия высокоэнергетического водорода НАДФ*Н не теряется: она сохраняется во вновь синтезированных веществах, и во многих случаях может быть использована при их катаболизме.
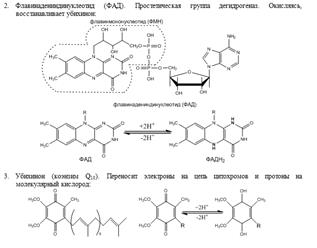
51. Флавиновые ферменты, убихинон, цитохромы и цитохромоксидаза. Флавиновые дегидрогеназы составляют группу дегидрогеназ. Флавиновые ферменты принимают участие в окислении жирных, янтарной и других кислот; инактивируют и окисляют высокотоксичные альдегиды, расщепляют в организме чужеродные D-изомеры аминокислот, образующиеся в результате жизнедеятельности бактерий; участвуют в синтезе коферментных форм витамина B6 и фолацина; поддерживают в восстановленном состоянии глутатион и гемоглобин. В ферментах коферменты функционируют как промежуточные переносчики электронов и протонов, отщепляемых от окисляемого субстрата. Коферментами для них являются флавинадениндиннуклеотид (ФАД) или флавиномононуклеотид (ФМН). Эти коферменты являются производными рибофлавина (витамин В2). Флавиновые коферменты прочно связаны с апоферментами, следовательно, флавиновые дегидрогеназы – это сложные белки. К флавиновым ферментам, содержащим ФМН, принадлежит НАД*Н-дегидрогеназа, которая окисляет НАД*Н. Акцептором водорода в этой реакции служит кофермент Q (убихинон), который может существовать в клетке в окисленной (убихинон Q) и восстановленной формах (убихинон QH2). НАД*Н-дегидрогеназа переносит водород с НАД*Н на убихинон. Дегидрогеназы, содержащие ФАД, катализируют отщепление водорода от групп –СН2-СН2- с образованием двойной связи. Кофермент Q (кофермент Q10, убихинон, ubiquinone, coenzyme Q10, coenzyme Q) — это группа коферментов —бензохинонов, содержащих хиноидную группу (отсюда обозначение Q) и содержащих несколько изопрениловых групп (например, 10 в случае кофермента Q10). Осн. ф-ция убихинонов- перенос электронов и протонов от разл. Субстратов к цитохромам при дыхании и окислительном фосфорилировании. Убихиноны, гл. обр. в восстановленной форме (убихинолы, QnH2), выполняют ф-цию антиоксидантов. Убихиноны могут быть простетич. группой белков. Выделены Q-связывающие белки трех классов, действующие в дыхат. цепи на участках функционирования ферментов сукцинату-бихинонредуктазы, НАДН-убихинонредуктазы и цитохромов в и с1. Цитохромы (гемопротеины) — это маленькие глобулярные белки, которые содержат ковалентно связанный гем, расположенный во внутреннем кармане, образованном аминокислотными остатками. Цитохромы присутствуют во всех клетках организмов. В клетках эукариот они локализованы в митохондриальных мембранах. Цитохромы катализируют окислительно-восстановительные реакции. Известно около 30 видов цитохромов. Все они содержат гем в качестве простетической группы и различаются структурами боковых и полипептидных цепей. В зависимости от типа гема выделяют 8 классов цитохромов. В зависимости от спектров поглощения, цитохромы делят на группы a, b, c. Цитохромы представляют собой гемопротеины (геминовые ферменты). Атом железа в геме цитохромов может менять валентность, присоединяя или отдавая электрон. Цитохромы дыхательной цепи обозначают латинскими буквами: b, c1, c, a, a3. Комплекс цитохромов a и а3 действует как цитохромоксидаза – помимо гема содержит ионы меди, которые тоже участвуют в переносе электронов, меняя валентность. Этот комплекс цитохромов переносит электроны с цитохрома с на кислород. Цитохром с-оксидаза (цитохромоксидаза), фермент класса оксидоредуктаз; катализирует конечный этап переноса электронов на кислород в процессе окислительного фосфорилирования.
|
||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 665; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.93.221 (0.005 с.) |