
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие представления о механизме ферментативного катализа. Количественная характеристика ферментативных реакций.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
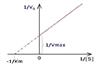
Ферменты — высокоэффективные катализаторы. Они повышают скорость катализируемой реакции в 1012 раз и более. Кинетика ферментативных реакций - раздел энзимологии, изучающий зависимость скорости химических реакций, катализируемых ферментами, от химической природы реагирующих веществ, а также от факторов окружающей среды. Скорость ферментативной реакции - мера каталитической активности фермента, ее обозначают как активность фермента. Математически скорость ферментативной реакции выражается в изменении концентрации субстрата (уменьшение) или продукта (увеличение) за единицу времени. К числу главных факторов, влияющих на скорость ферментативных реакций, относятся: концентрация фермента, концентрация субстрата, присутствие ингибиторов или активаторов, рН и температура среды. Процесс ферментативного катализа условно можно разделить на следующие три стадии: 1) Е + S -— ES (К - k1/k-1) (быстрая) 2) ES-----ЕР (к2)(медленная) 3) ЕР —- Е + Р Таким образом, в момент равновесия скорости образования и исчезновения комплекса (ES) равны: Е + S — ES-----ЕР — Е + Р Из уравнения Михаэлнса следует, что Кт численно равна конц. субстрата, при которой скорость реакции равна половине максимальной; действительно, при условии, что V= Vmax/2, имеем: Более удобно для определения величин Vmax и Кт использовать графики линеаризированых форм уравнения Михаэлиса: его называют уравнением Лайнуивера-Берка. Для характеристики способности ферментов изменять скорость реакций введено понятие активности. Активность выражают в каталах: 1 кат – количество фермента, которое превращает 1 моль субстрата за 1 с. Другой единицей активности является международная единица (E) – количество фермента, превращающего 1 мкмоль субстрата в 1 мин (1 E = 16,7 нкат). Ферменты специфически связывают реагенты (свои субстраты) в активном центре. При этом субстраты ориентируются таким образом, что приобретают оптимальное положение для образования переходного состояния. Сближение и необходимая ориентации реагентов значительно повышают вероятность образования продуктивного комплекса. Кроме того, связывание субстрата в активном центре приводит к удалению гидратной оболочки субстрата. В результате удаления молекул воды в активном центре фермента во время катализа создаются совершенно другие условия, чем в растворе. Еще одним важным фактором является стабилизация переходного состояния вследствие взаимодействия между аминокислотными остатками белка и субстратом. Таким образом, переходное состояние в случае ферментативной реакции требует меньшей энергии активации. Кроме того, многие ферменты во время катализа переносят специфические группировки с субстрата или на субстрат. Особенно часто осуществляется перенос протонов. Этот ферментативный кислотно-основной катализ значительно более эффективен, чем обмен протонов с кислотами и основаниями в растворе. Часто химические группировки ковалентно присоединяются к остаткам фермента. Это явление называют ковалентным катализом.
24. Принципы регуляции ферментативных процессов в клетке и регуляция метаболизма.Регуляция ферментативных процессов количеством субстрата и фермента. Локализация ферментов в клетке. Ингибирование избытком субстрата вследствие связывания последнего с функциональными группировками вне активного центра, либо вследствие взаимодействия с активным центром нескольких молекул субстрата Некоторые продукты ферментативных реакций также выступают в роли ингибиторов. Так, глюкоза ингибирует фермент Г-6-фосфатазу: Глюкозо-6-фосфат + Н20 à Глюкоза + Н3РО4 Ингибирование избытком субстрата наблюдается в ряде случаев в результате блокирования активного центра при присоединении двух мол-л субстрата (одна в связывающем другая в каталитическом центре) к ферменту. экстенсивная регуляция - обусловлена индукцией или репрессией генов, кодирующих синтез ферментов интенсивная регуляция - связана с изменением активности зрелых молекул фермента и определяется разнообразными механизмами аллостерическая регуляция - ряд ферментов имеют аллостерический центр, к которому присоединяются эффекторы, изменяющие конформацию белковой молекулы и, как следствие, а активность ферментов В клетке постоянно происходит большое количество разнообразных химических реакций, которые формируют метаболические пути - последовательное превращение одних соединений в другие. Катаболизм - распад сложных веществ до простых с высвобождением энергии. Анаболизм - синтез из простых более сложных веществ. Метаболические пути согласованы между собой по месту, времени и интенсивности протекания. Эта согласованность протекания всех процессов обеспечивается сложными и многообразными механизмами регуляции. Большинство ферментов имеет внутриклеточную локализацию и распределены в организме неравномерно. Все ферменты одного метаболического пути, как правило, находятся в одном отделе клетки. Особенно разделение метаболических путей важно для противоположно направленных катаболических и анаболических процессов. Например, синтез жирных кислот происходит в цитоплазме, а их распад в митохондриях. Если бы такого разделения не существовало, образовывались бы бесполезные с функциональной и энергетической точки зрения пути. В метаболических путях продукт первой ферментативной реакции служит субстратом второй и так далее до формирования конечного продукта. Промежуточные продукты метаболического пути могут высвобождаться из последовательности реакций и использоваться в других метаболических путях, т.е. метаболические пути связаны между собой промежуточными продуктами. Такая организация метаболического пути носит название мультиферментного комплекса и возникает в результате структурно-функциональной организации ферментов. В качестве примеров мультиферментных комплексов можно привести пируватдегидрогеназный комплекс, под действием которого происходит окислительное декарбоксилирование пировиноградной кислоты (пирувата), синтазу жирных кислот, катализирующую синтез пальмитиновой кислоты. Все химические реакции в клетке протекают при участии ферментов. Поэтому, чтобы воздействовать на скорость протекания метаболического пути, достаточно регулировать количество или активность ферментов. Обычно в метаболических путях есть ключевые ферменты, благодаря которым происходит регуляция скорости всего пути. Эти ферменты (один или несколько в метаболическом пути) называются регуляторными ферментами; они катализируют, как правило, начальные реакции метаболического пути, необратимые реакции, скорость-лимитирующие реакции (самые медленные) или реакции в месте переключения метаболического пути (точки ветвления). Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях: изменением количества молекул фермента; доступностью молекул субстрата и кофермента; изменением каталитической активности молекулы фермента. 2. Регуляция скорости ферментативной реакции доступностью молекул субстрата и коферментов Важный параметр, контролирующий протекание метаболического пути, - наличие субстратов, и главным образом - наличие первого субстрата. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути. Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Например, в реакциях дегидрирования коферментом дегидрогеназ служат окисленные формы NAD+, FAD, FMN, которые восстанавливаются в ходе реакции. Чтобы коферменты вновь участвовали в реакции, необходима их регенерация, т.е. превращение в окисленную форму. 3. Регуляция каталитической активности ферментов Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Основные способы регуляции активности ферментов: аллостерическая регуляция; регуляция с помощью белок-белковых взаимодействий; регуляция путём фосфорилирования/дефосфорилирования молекулы фермента; регуляция частичным (ограниченным) протеолизом.
25. Роль нуклеиновых кислот в формировании и свойствах живой материи.Основной постулат молекулярной биологии. Строение нуклеиновых кислот. Пуриновые и пиримидиновые основания. Углеводные компоненты. Нуклеиновые кислоты (НК) – высокомолекулярные соединения со строго определенной линейной последовательностью мономеров. Структура ДНК и РНК – способ «записи информации», обеспечивающий формирование в организме двух информационных потоков. Один из потоков осуществляет воспроизведение информации, заключенной в молекулах ДНК. Репликация – удвоение молекул ДНК. В результате этого процесса и последующего деления дочерние клетки наследуют геном родительской клетки. Происходит «считывание», или транскрипция, генов в форме полинуклеотидных последовательностей м-РНК и использование их в качестве матриц для синтеза соответствующих белков. При этом осуществляется «перевод» (трансляция) информации, заключенной в м-РНК, на «язык» аминокислот. Этот поток информации от ДНК через РНК на белок получил название «центральная догма биологии». Он характерен для всех живых организмов. Основная схема передачи генетической информации ДНК <-> РНК -> белок
Строение моносахаридов:
Нуклеиновые кислоты имеют различающийся состав. В частности, дезоксирибонуклеиновые кислоты (ДНК) содержат дезоксирибозу, а рибонуклеиновые кислоты (РНК)- рибозу.
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 609; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.147.146 (0.01 с.) |






 В каждом живом организме присутствуют 2 типа нуклеиновых кислот: РНК и ДНК. ДНК расположена в ядре клеток, а РНК находятся в ядре, ядрышке и цитоплазме. ДНК и РНК состоят из мономерных единиц – нуклеотидов, поэтому нуклеиновые кислоты называют полинуклеотидами. При полном гидролизе нуклеиновых кислот выделены: а) Азотистое основание: пуриновые и пиримидиновые основания; б) Углеводный компонент: моносахариды D-рибоза или 2-дезокси-D-рибоза; в) фосфорная кислота.
В каждом живом организме присутствуют 2 типа нуклеиновых кислот: РНК и ДНК. ДНК расположена в ядре клеток, а РНК находятся в ядре, ядрышке и цитоплазме. ДНК и РНК состоят из мономерных единиц – нуклеотидов, поэтому нуклеиновые кислоты называют полинуклеотидами. При полном гидролизе нуклеиновых кислот выделены: а) Азотистое основание: пуриновые и пиримидиновые основания; б) Углеводный компонент: моносахариды D-рибоза или 2-дезокси-D-рибоза; в) фосфорная кислота.




