
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общая характеристика рнк. Виды рнк. Особенности структуры, синтеза и функции м-рнк, т-рнк и р-рнк. .Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
РНК - нуклеиновые кислоты, полимеры нуклеотидов, в состав которых входят остаток ортофосфорной кислоты, рибоза (в отличие от ДНК, содержащей дезоксирибозу) и азотистые основания — аденин, цитозин, гуанин и урацил (в отличие от ДНК, содержащей вместо урацила тимин). Эти молекулы содержатся в клетках всех живых организмов, а также в некоторых вирусах. РНК принимают участие во всех стадиях процесса генной экспрессии и биосинтеза белка
Также в ядре клетки обнаружена ядерная РНК (яРНК), являющаяся предшественницей мРНК и тРНК. Синтез РНК (транскрипция).1. Инициация. σ-Субединица РНК-полимеразы связывается с промотором – специальным участком ДНК. К σ-субединице присоединяется кофермент, цепи ДНК раскручиваются и образуется открытый транскрипционный комплекс. Первым нуклеотидом с 5’-конца является гуанин, который метилируется (кэпируется), эта стартовая точка гена называется кэп-сайт. 2. Элонгация. Происходит синтез комплементарной цепи. При этом пройденные участки из 15-20 нуклеотидов вновь спирализуются. 3. Терминация. Синтез РНК замедляется по достижении стоп-сигнала. Затем синтезируется цепь по коду дополнительного сигнала и еще 15 следующих за ним нуклеотидов. В процессе отделения РНК от матрицы экзонуклеаза отщепляет терминальные 15 нуклеотидов, а полиА-полимераза достраивает 150-200 полиА-нуклеотидов. 4. Процессинг РНК. В отличие от ДНК, РНК не образуют двойных спиралей, но содержат короткие участки со спаренными основаниями. Это приводит к образованию субструктур, которые при двумерном изображении напоминают «шпильки» и петли, образующие фигуру типа «кленового листа». В таких структурах двухцепочечные участки соединены петлями. Транспортные РНК участвуют в процессе трансляции в качестве промежуточного связующего звена между нуклеиновыми кислотами и белками. Это небольшие молекулы РНК из 70-90 нуклеотидов, которые с помощью своих антикодонов "узнают" за счет спаривания оснований определенные кодоны на мРНК.
29. Рибосомы. Генетический код и его свойства. Трансляция. Генети́ческий код — свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов. Информация о строении белка закодирована в ДНК с помощью генетического кода, который является линейным, непрерывным, триплетным, выражденным. Он является универсальным. В ДНК используется четыре нуклеотида — аденин (А), гуанин (G), цитозин (С), тимин (T). Эти буквы составляют алфавит генетического кода. В РНК используются те же нуклеотиды, за исключением тимина, который заменён похожим нуклеотидом — урацилом, который обозначается буквой U. В молекулах ДНК и РНК нуклеотиды выстраиваются в цепочки и, таким образом, получаются последовательности генетических букв. Для построения белков в природе используется 20 различных аминокислот. Каждый белок представляет собой цепочку или несколько цепочек аминокислот в строго определённой последовательности. Эта последовательность определяет строение белка, а, следовательно, все его биологические свойства. Набор аминокислот также универсален почти для всех живых организмов.Реализация генетической информации в живых клетках (то есть синтез белка) осуществляется при помощи двух матричных процессов: транскрипции (то есть синтеза мРНК на матрице ДНК) и трансляции генетического кода в аминокислотную последовательность (синтез полипептидной цепи на мРНК). Для кодирования 20 аминокислот, а также сигнала «стоп», означающего конец белковой последовательности, достаточно трёх последовательных нуклеотидов. Набор из трёх нуклеотидов называется триплетом. Принятые сокращения, соответствующие аминокислотам и кодонам.
30. Регуляция синтеза белка у прокариотМутации, их виды и последствия. Оперон – это функциональная единица ДНК прокариот. Строение: 1. Промотор – участок, к которому присоединяется фермент РНК-полимераза 2. Оператор – участок, которому присоединяется репрессор, который не дает РНК-полимеразе двигаться по ДНК 3. Структурные гены – содержат информацию о структуре белка. У прокариот в одном опероне находятся гены нескольких белков, необходимых для осуществления какой-либо биохимической реакции. 4. Терминатор – участок, в котором РНК-полимераза отсоединяется от ДНК. Лактозный оперон открыли Жакоб, Моно и Львов в 1961 г. Его работа: 1. Когда в среде нет лактозы, кишечная палочка не вырабатывает ферменты, необходимые для ее расщепления, потому что к оператору присоединен репрессор, который не дает происходить транскрипции. 2. Когда в среде появляется лактоза, то она соединяется с белком-репрессором, он денатурирует и отсоединяется от оператора. Теперь ничто не мешает РНК-полимеразе делать иРНК, на которой рибосомы тут же делают белки. 3. Белки-ферменты расщепляют лактозу, в том числе и ту, что была присоединена к репрессору, он возвращается на место, транскрипция прекращается. Мута́ция — стойкое (то есть такое, которое может быть унаследовано потомками данной клетки или организма) изменениегенотипа, происходящее под влиянием внешней или внутренней среды. Процесс возникновения мутаций получил название мутагенеза. Спонтанные мутации возникают самопроизвольно на протяжении всей жизни организма в нормальных для него условиях окружающей среды Индуцированными мутациями называют наследуемые изменения генома, возникающие в результате тех или иных мутагенных воздействий в искусственных (экспериментальных) условиях или при неблагоприятных воздействиях окружающей среды. Существует несколько классификаций мутаций по различным критериям. В современной учебной литературе используется и более формальная классификация, основанная на характере изменения структуры отдельных генов, хромосом и генома в целом. В рамках этой классификации различают следующие виды мутаций: геномные; хромосомные; генные. Геномные: — полиплоидизация (образование организмов или клеток, геном которых представлен более чем двумя (3n, 4n, 6n и т. д.) наборами хромосом) и анеуплоидия (гетероплоидия) — изменение числа хромосом, не кратное гаплоидному набору При хромосомных мутациях происходят крупные перестройки структуры отдельных хромосом. В этом случае наблюдаются потеря (делеция) или удвоение части (дупликация) генетического материала одной или нескольких хромосом, изменение ориентации сегментов хромосом в отдельных хромосомах (инверсия), а также перенос части генетического материала с одной хромосомы на другую (транслокация) На генном уровне изменения первичной структуры ДНК генов под действием мутаций менее значительны, чем при хромосомных мутациях, однако генные мутации встречаются более часто. В результате генных мутаций происходят замены, делеции и вставки одного или нескольких нуклеотидов, транслокации, дупликации и инверсии различных частей гена. В том случае, когда под действием мутации изменяется лишь один нуклеотид, говорят о точечных мутациях. Возможны четыре генетических последствия точковых мутаций: 1) сохранение смысла кодона из-за вырожденности генетического кода (синонимическая замена нуклеотида), 2) изменение смысла кодона, приводящее к замене аминокислоты в соответствующем месте полипептидной цепи (миссенс-мутация), 3) образование бессмысленного кодона с преждевременной терминацией (нонсенс-мутация). В генетическом коде имеются три бессмысленных кодона: амбер — UAG, охр — UAA и опал — UGA 4) обратная замена (стоп-кодона на смысловой кодон).
31.Ферментативный гидролиз белков.Протеолитические ферменты, их специфичность, активация. Переваривание белков пищи начинается в желудке. Здесь в кислой среде белок денатурирует и подвергается действию пепсина – эндонуклеазы желудочного сока, которая гидролизует внутренние связи, образованные карбоксильной группой ароматических аминокислот (Phe +, Tyr+, Thr+). Образовавшиеся полинуклеотиды поступают в просвет тонкого кишечника. Здесь на них действуют четыре фермента панкреатического секрета: трипсин, химотрипсин, эластаза и карбоксипептидаза. Трипсин и химотрипсин гидролизуют связи, образованные аминогруппами основных (+Lys, +Arg) и ароматических аминокислот (+Phe, +Tyr, +Thr). Эластаза – эндонуклеаза широкого спектра действия. Карбоксипептидаза – экзонуклеаза, гидролизующая связь С-концевой аминокислоты.+N-CH(R)-COOH В пристеночной области кишечника олигонуклеотиды гидролизуются до свободных аминокислот ферментами кишечного сока – аминопептидазой, ди- и трипептидазой. Образовавшиеся свободные аминокислоты всасываются и поступают в кровоток. ПРОТЕОЛИТИЧЕСКИЕ ФЕРМЕНТЫ (протеазы), ферменты класса гидролаз, катализирующие гидролиз (протео-лиз) пептидных связей. Место расщепления пептидной связи в полипептидной цепи определяется позиционной и субстратной специфичностью фермента и пространств. структурой гидролизуемого субстрата (белка или пептида). Различают экзопептидазы, расщепляющие связи вблизи С- или N-конца цепи (соотв. карбоксипептидазы и аминопеп-тидазы)и эндопептидазы (протеиназы), гидролизующие связи, удаленные от концевых остатков (напр., трипсин). Лишь ограниченное число протеолитических ферментов обладает строгой субстратной специфичностью. К ним относят, напр., ренин, гидроли-зующий связь между остатками лейцина в положениях 10 и 11 в ангиотензиногене (предшественник ангиотензина пептида, участвующего в регуляции кровяного давления). В зависимости от локализации фермента протеолиз происходит при разл. рН. Так, протеолитические ферменты желудка (напр., пепсин, гастриксин) функционируют при рН 1,5-2, лизосомные ферменты-при рН 4-5, а протеолитические ферменты сыворотки крови, тонкого кишечника и др.-при нейтральных или слабощелочных значениях рН. Нек-рые протеолитические ферменты используют в качестве кофактора ионы металлов-Са2+, Mg2+ и др. Дефектные и чужеродные белки деградируют в клетке при участии АТФ-зависимой системы протеолиза. У эукариот (все организмы, кроме бактерий и синезеленых водорослей) эта система включает низкомол. белок убикитин, образующий с белками-субстратами конъюгат, и протеазы, расщепляющие этот конъюгат.
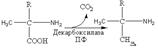
32.Общая схема источников и расходования аминокислот в организме. Незаменимые аминокислоты. Общие пути катаболизма аминокислот. Доставленные с кровотоком аминокислоты в печень имеют несколько основных путей метаболизма: 1. Биосинтеза белка – протекает как в самой печени, так и в других тканях. 2. Трансаминирование и использование углеродного скелета для биосинтеза глюкозы, жирных кислот и кетоновых тел, биосинтеза АТФ. 3. Декарбоксилирование с образованием биологически активных биогенных аминов (дофамин, норадреналин и адреналин (синтезируются изначально из аминокислоты тирозина), серотонин, мелатонин и триптамин (синтезируются из триптофана). 4. Биосинтез нуклеотидов, порфиринов, гормонов. Трансаминирование и дезаминирование аминокислот Часть аминокислот, поступивших в избыточном количестве с пищей, либо образовавшиеся в результате распада тканевых белков, теряют аминогруппу и превращаются в кетокислоту. В процессе трансаминирования аминогруппа переносится на кетокислоту, в роли которой выступает 2-кетоглутарат, пируват или оксалоацетат, которые образуют глутамат, аланин и аспартат соответственно. Далее аминогруппа аланина и аспартата переносится на 2-кетоглутарат с образованием глутамата (непрямое дезаминирование). Глутамат – единственная аминокислота подвергающаяся окислительному дезаминированию. В результате дезаминирования аминогруппа отщепляется в виде аммиака, который метаболизируется печенью. Углеродные скелеты аминокислот могут быть вовлечены в ЦТК и окислены до конечных продуктов, либо использованы для биосинтеза глюкозы (глюкогенные аминокислоты), жирных кислот или кетоновых тел (кетогенные аминокислоты). Глюкогенные аминокислоты образуют одно из пяти соединений, которые через оксалоацетат вовлекаются в глюконеогенез. Кетогенные аминокислоты образуют ацетоацетат или ацетил-КоА. Ряд аминокислот дают метаболиты обоих видов и являются одновременно кетогенныи и глюкогенными. Декарбоксилирование аминокислот В результате отщепления карбоксильной группы аминокислоты образуют биогенные амины, многие из которых выполняют важные биологические функции. Так, серин образует этанолмаин, включаемый в состав фосфолипидов; глутамат – нейромедиатор γ-аминомасляную кислоту (ГАМК); гистидин – медиатор гистамин. Дезактивация биогенных аминов происходит путем их окислительного дезаменирования и дальнейшего окисления в карбоновые кислоты. Двенадцать из двадцати аминокислот могут быть синтезированы de novo в организме. При этом цистеин и тирозин образуются из незаменимых метионина и фенилаланина, а аргинин и гистидин синтезируются в незначительных количествах. Оставшиеся восемь получаются в результате переноса аминогруппы глутамата на кетокислоты-предшественники реакция в обмене аминок-т 11рис Вещества, образованные при внутриклеточном гидролизе или проникающие в клетку из крови, на втором этапе обычно превращаются в пировиноградную кислоту, ацетильную группу (в составе ацетил-S-КоА) и в некоторые другие мелкие органические молекулы. Локализация второго этапа – цитозоль и митохондрии. Часть энергии рассеивается в виде тепла и примерно 13% энергии вещества усваивается, т.е. запасается в виде макроэргических связей АТФ Ацетил-SКоА включается в реакции цикла трикарбоновых кислот и окисляется до углекислого газа. Выделенные атомы водорода соединяются с НАД и ФАД и восстанавливают их. После этого НАДН и ФАДН2 переносят водород в цепь дыхательных ферментов, расположенную на внутренней мембране митохондрий. Здесь в результате процесса под названием "окислительное фосфорилирование" образуется вода и главный продукт биологического окисления – АТФ. 33.ПЕРЕАМИНИРОВАНИЕ (трансаминирование), обратимый перенос аминогруппы из молекулы одного орг. соед. в молекулу другого. Наиб. роль переаминирование играет в биохимии в процессах метаболизма азотистых оснований. Переаминирование аминокислот может происходить и вне клетки в присут. пиридоксаль-5'-фосфата, однако скорость р-ции в 106 раз меньше. Часть аминокислот, поступивших в избыточном количестве с пищей, либо образовавшиеся в результате распада тканевых белков, теряют аминогруппу и превращаются в кетокислоту. В процессе трансаминирования (рис.10) аминогруппа переносится на кетокислоту, в роли которой выступает 2-кетоглутарат, пируват или оксалоацетат, которые образуют глутамат, аланин и аспартат соответственно. Далее аминогруппа аланина и аспартата переносится на 2-кетоглутарат с образованием глутамата (непрямое дезаминирование). Глутамат – единственная аминокислота подвергающаяся окислительному дезаминированию. В результате дезаминирования аминогруппа отщепляется в виде аммиака, который метаболизируется печенью. Углеродные скелеты аминокислот могут быть вовлечены в ЦТК и окислены до конечных продуктов, либо использованы для биосинтеза глюкозы (глюкогенные аминокислоты), жирных кислот или кетоновых тел (кетогенные аминокислоты). Глюкогенные аминокислоты образуют одно из пяти соединений, которые через оксалоацетат вовлекаются в глюконеогенез. Кетогенные аминокислоты образуют ацетоацетат или ацетил-КоА. Ряд аминокислот дают метаболиты обоих видов и являются одновременно кетогенныи и глюкогенными (пролин, лейцин и др). Нарушение нормального течения переаминирования в организме наблюдается при патологич. состояниях, напр. при инфаркте миокарда, заболеваниях печени. Контроль концентрации аминотрансфераз используется в этих случаях как ср-во диагностики.
34. Образование аммиака. Транспорт аммиака.Восстановительное аминирование. Амиды и их физиологическое значение. БИОГЕННЫЕ АМИНЫ Образуются при декарбоксилировании аминокислот. Биогенные амины (БА) являются непептидными азотсодержащими производными аминокислот. К ним относятся гормоны надпочечников (адреналин, норадреналин), щитовидной железы (тироксин, трийодтиронин), медиаторы ЦНС (ацетилхолин, ГАМК, дофамин), медиатор воспаления (гистамин), этаоламин, аминопропанол и др. Некоторые из этих соединений являются составными частями других биомолекул.
Амины, образовавшиеся при декарбоксилировании аминокислот, часто являются биоактивными веществами. Серотонин – нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС. -Аминомасляная кислота (ГАМК). В нервных клетках декарбоксилирование глутамата приводит к образованию ГАМК, которая служит основным тормозным медиатором высших отделов мозга. Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов, что вызывает торможение нервного импульса; повышает дыхательную активность нервной ткани; улучшает кровоснабжение головного мозга. Аминомасляная кислота (ГАМК). В нервных клетках декарбоксилирование глутамата приводит к образованию ГАМК, которая служит основным тормозным медиатором высших отделов мозга. Содержание ГАМК в головном мозге в десятки раз выше других нейромедиаторов. Она увеличивает проницаемость постсинаптических мембран для ионов, что вызывает торможение нервного импульса; повышает дыхательную активность нервной ткани; улучшает кровоснабжение головного мозга. Гистамин выполняет в организме человека следующие функции: --стимулирует секрецию желудочного сока, слюны; --повышает проницаемость капилляров, вызывает отеки, снижает АД; --сокращает гладкую мускулатуру легких, вызывает удушье; --участвует в формировании воспалительной реакции – вызывает расширение сосудов, покраснение кожи, отечность ткани; – вызывает аллергическую реакцию; -выполняет роль нейромедиатора; -является медиатором боли.
Образующийся в результате реакций дезаминирования аммиак является токсичным для организма. В печени аммиак карбоксилируется с образованием карбамоилфосфата, который вовлекается в орнитиновый цикл. На последнем этапе этого процесса образуется аргинин, который распадается на орнитин и мочевину, либо преобразуется в креатин. В мышцах креатин фосфорилируется и используется в качестве донора фосфатной группы при регенерировании АТФ из АДФ. Образовавшиеся креатинин и мочевина выводятся из организма. реакция в обмене аминок-т рис13 Восстановительное аминирование - это превращение кетонов в соответствующие им амины.
35. Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ. СПЕЦИФИЧЕСКИЕ ПУТИ ОБМЕНА ОТДЕЛЬНЫХ АМИНОКИСЛОТ. Эти пути обмена определяются различиями в строении радикалов аминокислот, поэтому они разнообразны и многочисленны. Вступая в эти специфические реакции, АК-ты принимают участие во многих важных процессах:а) в синтезе гормонов и нейромедиаторов, б) в синтезе простетических групп сложных белков - хромопротеинов и нуклеопротеинов, в) в синтезе сложных липидов, г) синтезе веществ, содержащих макроэргическую связь и являющихся источником энергии для клеток, д) в обезвреживании токсических веществ. ОБМЕН СЕРУСОДЕРЖАЩИХ АМИНОКИСЛОТ: МЕТИОНИНА И ЦИСТЕИНА.Метионин - это незаменимая аминокислота, а цистеин - заменимая.S-аденозил-метионин участвует в реакциях трансметилирования. Наиболее важный из них синтез фосфатидилхолина из фосфатидилэтаноламина, обезвреживание биогенных аминов с участием О-метилтрансфераз, синтез адреналина из норадреналина, синтез ацетилхолина из холина и Ацетил-КоА, синтез креатина, который в виде креатинфосфата является резервной формой макроэргических связей и участвует в обеспечении нервной ткани и работающей мышцы АТФ. ОБМЕН ЦИКЛИЧЕСКИХ АМИНОКИСЛОТ ФЕНИЛАЛАНИНА И ТИРОЗИНАФенилаланин является незаменимой аминокислотой, а тирозин - заменимая аминокислота.Тирозин вступает в многочисленные реакции в различных тканях. В результате этих превращений тирозин не только распадается до конечных продуктов, но и дает промежуточные метаболиты, из которых образуются ряд важных соединений, некоторые из которых являются биологически активными веществами. Из тирозина образуются:а) гормоны мозгового слоя надпочечников адреналин и норадреналин,б) меланины - пигменты кожи, волос, радужной оболочки глаза,в) йодсодержащие гормоны щитовидной железы - тироксин и трийодтиронин. фенилкетонурия - нарушен синтез фенилаланин-гидроксилазы, поэтому фенилаланин превращается в фенилпируват, который оказывает токсическое воздействие на развитие некоторых отделов головного мозга.2) альбинизм - нарушен синтез ферментов, превращающих ДОФА в ДОФА-хром, поэтому нарушается синтез меланинов. 3) алкаптонурия - нарушен синтез диоксигеназы гомогентизиновой кислоты, она выделяется с мочой, моча приобретает черный цвет.4) кретинизм - нарушен синтез йодиназы, что приводит к нарушению синтеза йодсодержащих гормонов щитовидной железы.5) может быть нарушен синтез фермента тирозиназы, который катализирует превращение тирозина в ДОФА, следовательно будет нарушаться синтез гормонов мозгового слоя надпочечников и меланина.Из всех этих заболеваний в настоящее время удается лечить фенилкетонурию, для этого из рациона ребенка исключают фенилаланин и увеличивают в пище количество тирозина. Если ребенка держать на этой диете до 6-7 лет, тогда не возникает умственная отсталость, т.к. к 6-7 годам успевают развиться отделы головного мозга, развитие которых задерживается при избытке в ткани мозга фенилпирувата.
36.Биосинтез мочевины. Орнитиновый цикл мочевинообразования. Образующийся в результате реакций дезаминирования аммиак является токсичным для организма. В печени аммиак карбоксилируется с образованием карбамоилфосфата, который вовлекается в орнитиновый цикл. На последнем этапе этого процесса образуется аргинин, который распадается на орнитин и мочевину, либо преобразуется в креатин. В мышцах креатин фосфорилируется и используется в качестве донора фосфатной группы при регенерировании АТФ из АДФ. Образовавшиеся креатинин и мочевина выводятся из организма. В карте обмена АК-т от аммиака до карбамоил-фосфата к мочеине.
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 1843; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.101.7 (0.015 с.) |

 Структура и функции РНК.В цитоплазме клеток содержатся три основных вида РНК: матричная РНК (мРНК) выполняет роль матрицы при синтезе белка. Имеет сложную вторичную структуру. В целом линейная молекула мРНК имеет несколько двухспиральных шпилек, на концах которых располагаются «знаки» инициации и терминации трансляции транспортная РНК (тРНК) выполняет функцию посредника в ходе трансляции мРНК, транспортирует аминокислоту на рибосому. Вторичная структура имеет форму клеверного листа; рибосомная РНК (рРНК) формируют основу, с которой связываются специфические белки при образовании рибосомы.
Структура и функции РНК.В цитоплазме клеток содержатся три основных вида РНК: матричная РНК (мРНК) выполняет роль матрицы при синтезе белка. Имеет сложную вторичную структуру. В целом линейная молекула мРНК имеет несколько двухспиральных шпилек, на концах которых располагаются «знаки» инициации и терминации трансляции транспортная РНК (тРНК) выполняет функцию посредника в ходе трансляции мРНК, транспортирует аминокислоту на рибосому. Вторичная структура имеет форму клеверного листа; рибосомная РНК (рРНК) формируют основу, с которой связываются специфические белки при образовании рибосомы.
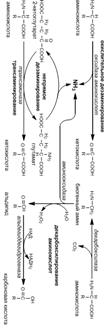
 Его дезактивация с образованием нетоксичных мочевины и креатина происходит в печени, куда он предварительно должен быть транспортирован кровью. Трансортными формами аммиака являются аспарагин и глутамин, образующиеся амидированием аспартата и глутамата. Реакции катализируются аспарагин- и глутаминсинтетазой. В печени аспарагиназа и глутаминаза отщепляют амидную группу в виде аммиака.
Его дезактивация с образованием нетоксичных мочевины и креатина происходит в печени, куда он предварительно должен быть транспортирован кровью. Трансортными формами аммиака являются аспарагин и глутамин, образующиеся амидированием аспартата и глутамата. Реакции катализируются аспарагин- и глутаминсинтетазой. В печени аспарагиназа и глутаминаза отщепляют амидную группу в виде аммиака. Его дезактивация с образованием нетоксичных мочевины и креатина происходит в печени, куда он предварительно должен быть транспортирован кровью. Трансортными формами аммиака являются аспарагин и глутамин, образующиеся амидированием аспартата и глутамата. Реакции катализируются аспарагин- и глутаминсинтетазой. В печени аспарагиназа и глутаминаза отщепляют амидную группу в виде аммиака.
Его дезактивация с образованием нетоксичных мочевины и креатина происходит в печени, куда он предварительно должен быть транспортирован кровью. Трансортными формами аммиака являются аспарагин и глутамин, образующиеся амидированием аспартата и глутамата. Реакции катализируются аспарагин- и глутаминсинтетазой. В печени аспарагиназа и глутаминаза отщепляют амидную группу в виде аммиака.


