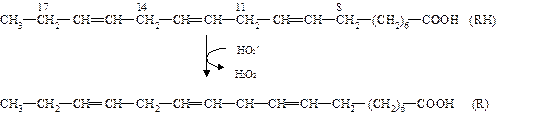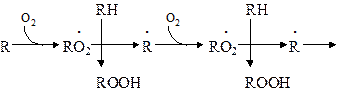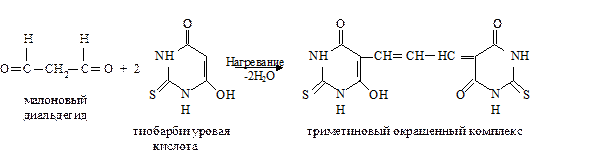Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование пероксидного окисления липидовСодержание книги
Поиск на нашем сайте
Биологических мемебран
Пероксидное (перекисное) окисление липидов молекулярным методом представляет собой цепной свободно-радикальный процесс. Наиболее легко подобным образом окисляются ненасыщенные липиды или свободные жирные кислоты, входящие в состав фосфолипидов биологических мембран. Поэтому скорость пероксидного окисления липидов прежде всего оказывает влияние на функцию мембран и на развитие в них патологических изменений. Зарождение этого процесса связывают с появлением в среде, например, пероксидного радикала НО2 ˙, возникающего при окислении Fe2+ молекулярным кислородом:
Fe2+ + O2 + H+ → Fe3+ + HO2 ˙
Пероксидный радикал может реагировать с молекулой ненасыщенного липида или свободной жирной кислоты (RH) биомембран. При этом образуется липидный радикал R ˙.
HO2 ˙ = RH →H2O2 + R ˙,
который запускает цепную реакцию окисления липидов (стадия инициирования, или зарождения цепей). Образование R ˙ связано с отрывом атома водорода от углерода, находящегося в α-положении к двойной связи, например, в положениях 8, 11, 14 и 17 линоленовой кислоты:
Если радикал образуется при отрыве атома водорода в положении 11 или 14, то электрон неспаренной валентности делокализуется, что приводит к появлению молекул липида с двумя сопряженными двойными связями (диеновые конъюгаты), имеющих максимум поглощения при 233 нм. В присутствии кислорода радикал R ˙ дает новый свободный радикал липида – пероксидный RO2 ˙.
Пероксидный радикал может взаимодействовать с новой молекулой жирной кислоты RH с образованием гидропероксида (гидроперекиси) липида ROOH и очередного липидного радикала R ˙;
Причем сопряженные двойные связи (диеновая конъюгация), отмеченные в формулах скобкой, сохраняются в гидропероксидах липидов, образующих при свободнорадикальном окислении таких полиненасыщенных жирных кислот, как линолевая, линоленовая, арахидоновая. Две последние реакции сохраняют присутствие радикалов RO2 и R в системе, обеспечивая продолжение цепного окисления липидов:
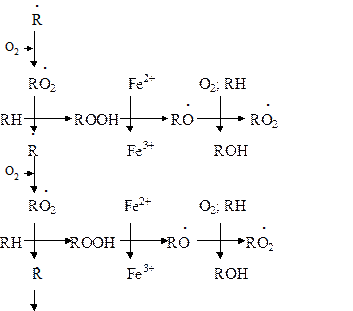
Подобная цепь пероксидного окисления липидов называется неразветвленной. Длина ее зависит от числа радикалов RO2 ˙, которые «ведут» цепное окисление. Каждый радикал приводит к образованию нескольких молекул ROOH, по числу которых судят о длине неразветвленных цепей пероксидного окисления липидов. Следовательно, первичными продуктами пероксидного окисления липидов являются гидропероксиды липидов, среди которых определенный процент падает на диеновые конъюгаты. При разложении накопившихся гидропероксидов липидов с участием Fe2+ появляется новый радикал – RO (оксидный радикал жирной кислоты, или алкоксидный радикал):
ROOH + Fe2+ → RO + OHˉ + Fe3+
Далее пероксидное окисление липидов развивается по разветвленному механизму: При этом накапливаются другие продукты пероксидного окисления липидов: спирты, кетоны, эпоксиды, альдегиды и диальдегиды и т.д. Среди диальдегидов представляет интерес малоновый диальдегид CH2(CHO)2, который образуется при свободнорадикальном окислении линоленовой и арахидоновой кислот, но не олеиновой или линолевой. Его определение служит одним из методов исследования пероксидного окисления липидов. Пероксидное окисление фосфолипидов и ненасыщенных жирных кислот, входящих в состав биомембраны, может полностью разрушить ее липидную основу. Однако этому препятствует взаимодействие радикалов R ˙ и RO2 друг с другом, реакция тех же радикалов с Fe2+ и взаимодействие радикалов с антиоксидантами. При этом в первых двух реакциях образуются молекулярные продукты, а в третьей – малоактивные радикалы антиоксиданта, что вызывает обрыв цепей свободнорадикального окисления. В клетках выделяют два типа пероксидного окисления липидов – ферментный и неферментный, которые отличаются рядом признаков. Ферментная система требует участия ферментного белка (поэтому в отличие от неферментной инактивируется нагреванием), пирофосфата, ионов железа и в качестве восстановителя НАДФ·Н (НАДФ·Н-зависимая ферментная система пероксидного окисления, НЗП). Неферментная система нечувствительна к нагреванию; она требует ионов железа и аскорбата в качестве восстановителя (аскорбат-зависимое неферментное пероксидное окисление, АЗП). Отличительным признаком этих двух систем служит чувствительность к ионам железа, пирофосфата и фосфата. Система НЗП имеет очень высокое сродство к ионам железа, поэтому достаточно следовых количеств их для протекания максимальной скорости реакций. Для тех же условий АЗП требует значительных концентраций ионов железа, которые добавляются в среду при исследовании этого процесса в клетках. Активность НЗП резко усиливается пирофосфатом и угнетается фосфатом, тогда как АЗП ингибируется обоими веществами. Наиболее активны обе системы пероксидного окисления в мембранах микросом. Обнаружено также пероксидное окисление липидов, особенно АЗП, в митохондриях, лизосомах, мембранах эритроцитов и т.д. Накопление таких продуктов пероксидного окисления, как гидропероксиды липидов, приводит к ингибированию многих ферментных белков и нарушает их функцию. Кетоны, альдегиды и диальдегиды образуют ковалентные внутримолекулярные и межмолекулярные связи («сшивки») и с функциональными группами белков и других биомолекул, что также ведет к изменениям клеточных функций. Развитию свободнорадикальных реакций окисления липидов способствуют прооксиданты, а сдерживают его ингибиторы – антиоксиданты. К последним относятся α-токоферол, селен, некоторые гормоны (тироксин, стероидные) и т.д. От вредного действия гидропероксидов липидов клетку защищает ферментная система глутатионпероксидазы, разрушающая эти вещества. Для исследования процессов пероксидного окисления липидов используются методы: а) определения продуктов пероксидного окисления липидов; б) регистрации свободных радикалов в ходе реакции; в) определения антиокислительной (антиоксидантной) активности тканей. Первые два наиболее просты для выполнения и нашли широкое применение, в частности, метод определения наиболее изученного продукта пероксидного окисления – малонового диальдегида.
Работа 107. Определение чувствительности эритроцитов к пероксидному гемолизу
Реактивы. Фосфатный буфер, 1М раствор с рН 7,4*; хлорид натрия, 170 г/л раствор; рабочий свежеприготовленный раствор хлорида натрия, объем смеси доводят до 1 л и перед употреблением насыщают кислородом воздуха путем встряхивания; фосфатный буфер, 0,17 М раствор с рН 7,4х; раствор гидрохлорида натрия, приготовленный на фосфатном буфере (0,17 М фосфатный буфер и 1%-ный раствор NaCl в соотношении 1:3 по объему); изотонический спиртовой раствор эргокальциферола Д2 (продажный препарат 0,5%-ного спиртового раствора эргокальциферола разбавляют в 50 раз раствором гидрохлорида натрия на фосфатном буфере); аммиачный раствор (растворяют 1 мл концентрированного раствора аммиака в колбе вместимостью 250 мл); ацетат α-токоферола, 5%-ный масляный раствор. Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 5 и 10 мл; стеклянные палочки; центрифуга с центрифужными весами; термостат, отрегулированный на 38˚С; ФЭК или спектрофотометр. Материал. Кровь, взятая из пальца.
а. Определение спонтанного гемолиза по Ягеру. Метод основан на определении при 540 нм экстинкции внеэритроцитарного гемоглобина, поступающего в среду вследствие спонтанного лизиса мембран эритроцитов, вызванного пероксидным окислением липидов кислородом воздуха. Ход определения. В пробирку с 7,5 мл рабочего раствора хлорида натрия добавляют 0,1 мл крови. Готовят суспензию эритроцитов, втягивая и выдувая жидкость с помощью пипетки. Центрифугируют взвесь 10 мин при 1000 об/мин, надосадочную жидкость осторожно отсасывают. К осадку эритроцитов добавляют 7,5 мл рабочего раствора хлорида натрия и вновь суспензируют тем же способом. В три центрифужные пробирки наливают по 1 м приготовленной суспензии: в первые две пробирки прибавляют по 4 мл рабочего раствора хлорида натрия; а в третью – 4 мл дистиллированной воды (для полного гемолиза). Пробы перемешивают стеклянной палочкой и ставят на 2 ч в термостат при 38˚С. По окончании инкубации содержимое пробирок перемешивают, центрифугируют 10 мин при 1000 об/мин и измеряют экстинкцию всех проб против дистиллированной воды на ФЭКе или спектрофотометре при 540 нм (светофильтр зеленый) в кювете с толщиной слоя 1 см. Расчет проводят по формуле
(Е1 + Е2)100 х = ————————, 2Е3
где х – степень гемолиза, %; Е1 и Е2 – экстинкции первой и второй проб; Е3 – экстинкция третьей пробы. б. Исследование гемолитического действия витамина D2 (эргокальциферола) по В.Б.Спиричеву и Н.В.Блажеевич. Метод основан на определении при 540 нм экстинкции внеэритроцитарного гемоглобина, выход которого усиливается с помощью витамина D2, запускающего пероксидное окисление липидов в мембранах эритроцитов. α-токоферол как антиоксидант уменьшает гемолитическую активность эргокальциферола. Ход определения. В три пробирки вносят по 0,1 мл крови. В одну предварительно наливают 4 мл изотонического раствора эргокальциферола (прооксидант), а в другую – тот же объем раствора эргокальциферола и 1 каплю раствора ацетата α-токоферола (антиоксидант), в третью – 4 мл раствора хлорида натрия на фосфатном буфере (контроль). Суспензируют эритроциты во всех пробах, втягивая и выдувая жидкость с помощью пипетки, и оставляют стоять при 20-22˚С. Через 30 мин пробы центрифугируют в течение 10 мин при 3000 об/мин, отбирают 0,1 мл надосадочной жидкости в три чистые пробирки и прибавляют в них по 5 мл аммиачного раствора. Осадок эритроцитов в центрифужных пробирках вновь суспензируют, втягивая и выдувая жидкость пипеткой, и оставляют их стоять при 20-22˚С еще на 30 мин. По истечении этого времени пробы вновь центрифугируют в том же режиме, отбирают по 0,1 мл надосадочной жидкости в три чистые пробирки и приливают в них по 5 мл аммиачного раствора. После добавления аммиачного раствора все шесть пробирок закрывают кусочком фольги и энергично встряхивают содержимое 2 мин. Затем измеряют экстинкцию в пробах против контроля на ФЭКе или на спектрофотометре при 540 нм (светофильтр зеленый) в кювете с толщиной слоя 1 см. Расчет проводят по формуле
Е3100 Е2100 х = ———— и А = —————, Е1 Е1
где х – степень гемолиза при добавлении эргокальциферола, %; Е1 – экстинкция пробы с эргокальциферолом; Е3 – экстинкция контрольной пробы; А – степень гемолиза после совместного добавления эргокальциферола и α-токоферола, % Е2 – экстинкция пробы с эргокальциферолом и α-токоферолом. Торможение антиоксидантом пероксидного окисления (в %) рассчитывают по формуле А100 —————. х
Оформление работы. Провести необходимые расчеты и сделать вывод о причинах спонтанного гемолиза, а также о действии изучаемых прооксидантов и антиоксидантов. Практическое значение работы. По степени гемолиза эритроцитов можно судить о состоянии антиокислительных систем клетки, в частности, об обеспеченности организма витамином Е. При нормальной обеспеченности спонтанный гемолиз, как правило, составляет 2-10%. Недостаток витамина Е резко повышает этот показатель. Имеется соответствие между спонтанным или индуцированным гемолизом и содержанием токоферолов в сыворотке крови. Способность витамина D2 ускорять пероксидное окисление липидов в мембранах эритроцитов и других клеток свидетельствует о его прооксидантных свойствах.
Работа 108. Определение скорости пероксидного окисления липидов в биомембранах
Реактивы. Трис-HCl буфер, 0,04 М раствор с рН 7,4*; соль Мора – Fe(NH4)2(SO4)2, 4·10-5 М свежеприготовленный раствор; трихлоруксусная кислота, 40%-ный раствор; тиобарбитуровая кислота, 0,8%-ный свежеприготовленный раствор; оксалат натрия, 1,34%-ный раствор; хлорид натрия, 0,9%-ный раствор; хлорид калия, 1,2%-ный раствор. Оборудование. Штатив с пробирками; пипетки вместимостью 0,1; 1 и 5 мл; пастеровские пипетки; резиновая груша; водяная баня с термометром или водяная баня аппарата Варбурга; аптечные весы с разновесами; спектрофотометр или ФЭК типа КФК-2.
Материал. 1. Кровь, взятая в смеси с раствором оксалата натря в соотношении 10:1 (по объему). 2. Печень свежезабитого животного.
а. Определение скорости пероксидного окисления липидов в мембранах эритроцитов. Метод основан на определении содержания конечного продукта пероксидного окисления липидов – малонового диальдегида, который при взаимодействии с тиобарбитуровой кислотой образует окрашенный в розовый цвет триметиновый комплекс, имеющий максимум поглощения при 530-532 нм:
Окраска раствора пропорциональна концентрации малонового диальдегида. Молярный коэффициент экстинкции 1,56·10-5л·моль-1·см-1. Ход определения. Оксалатную кровь центрифугируют 10 мин при 3000 об/мин, осаждая эритроциты. Верхний слой отсасывают, а осадок эритроцитов трижды промывают раствором хлорида натрия и переосаждают при том же режиме центрифугирования. Отбирают 0,5 мл осадка эритроцитов в чистую центрифужную пробирку, приливают равный объем дистиллированной воды и оставляют стоять 30 мин для полного гемолиза. Пробу центрифугируют 30 мин при 3000 об/мин, осторожно отсасывают пастеровской пипеткой надосадочную жидкость с серой прослойкой мембран эритроцитов и переносят в другую пробирку. Берут три чистые пробирки. В первую опытную вносят по 0,3 мл растворов соли Мора, трис-буфера, аскорбиновой кислоты и 0,1 мл полученной взвеси мембран эритроцитов. Во вторую опытную приливают 0,3 мл трис-буфера, 0,1 мл взвеси мембран эритроцитов и 0,6 мл дистиллированной воды. В третью (контроль) добавляют те же реактивы, что и в первую пробирку, после чего сразу приливают 1 мл раствора трихлоруксусной кислоты. Все пробирки помещают в водяную баню (или в баню аппарата Варбурга) и инкубируют пробы 20 мин при 37˚С. Реакцию в опытных пробах останавливают, добавляя в обе пробирки по 1 мл раствора трихлоруксусной кислоты. Все пробы центрифугируют 15 мин при 3000 об/мин. Сливают надосадочную жидкость (ее объем 2 мл) в три другие пробирки, прибавляют по 1 мл раствора тиобарбитуровой кислоты и помещают пробы на 10 мин в кипящую водяную баню. Затем пробирки охлаждают в ледяной воде. Измеряют экстинкцию полученных проб против контроля на спектрофотометре при 532 нм или на ФЭКе (светофильтр зеленый) в кювете с толщиной слоя 1 см. Расчет по формулам
Е13∙6 Е23∙6 х1 = ———— и х2 = ————, 0,156 0,156
где х1 – скорость образования в пробе малонового диальдегида в присутствии прооксидантов (индуцированное пероксидное окисление липидов), нмоль∙ч-1; х2 – скорость образования в пробе малонового диальдегида в отсутствие прооксидантов (спонтанное пероксидное окисление липидов), нмоль∙ч-1; 3 – объем пробы, мл; 6 – коэффициент пересчета на 1 час; 0,156 – экстинкция 1 нмоля при 532 нм; Е1 и Е2– экстинкции соответственно первой и второй проб против контроля. б. Определение скорости пероксидного окисления липидов в гомогенатах тканей. Принцип метода описан выше. Ход определения. Навеску 0,5 г печени гомогенизируют в 19,5 мл охлажденного до 0-4˚С раствора хлорида калия, поместив стакан гомогенизатора в лед или снег. Полученный гомогенат сливают в пробирку. В одну пробирку наливают 2,0 мл гомогената и 0,2 мл дистиллированной воды, во вторую – 2 мл гомогената и по 0,1 мл растворов аскорбиновой кислоты и соли Мора, в третью – те же вещества, что и во вторую, и, кроме того, добавляют 1 мл раствора трихлоруксусной кислоты. Все пробирки помещают на 10 мин в водяную баню при 37˚С, после чего прибавляют в первые две пробирки по 1 мл раствора трихлоруксусной кислоты. Далее все пробы центрифугируют 10 мин при 3000 об/мин. По 2 мл надосадочной жидкости отбирают в три чистые пробирки, приливают по 1 мл раствора тиобарбитуровой кислоты и помещают пробы в кипящую водяную баню на 10 мин. После этого их охлаждают в ледяной воде до комнатной температуры. Измеряют экстинкцию всех проб против контрольного раствора (2 мл раствора хлорида калия, 1 мл раствора трихлоруксусной кислоты и 1 мл раствора тиобарбитуровой кислоты, выдерживают 10 мин на кипящей водяной бане и охлаждают в ледяной воде до комнатной температуры) на спектрофотометре при 532 нм или ФЭКе (светофильтр зеленый) в кювете с толщиной слоя 1 см. Расчет проводят по формулам:
Е1(Е2)3∙3,2∙6 Е33∙3,2 х1 (х2)= —————— и х3 = ——————, 0,156∙2 0,156∙2
где х1 – скорость спонтанного пероксидного окисления липидов в гомогенатах, измеряющаяся в наномолях образовавшегося малонового диальдегида в пробе за час инкубации; х2 – скорость аскорбат-зависимого неферментативного пероксидного окисления липидов в наномолях образовавшегося малонового диальдегида в пробе за час инкубации; х3 – содержание малонового диальдегида в исходном гомогенате, нмоль; Е1, Е2 и Е3– экстинкции соответственно первой, второй и третьей проб; 3,2 – общий объем исследуемых проб, мл; 2 – объем надосадочной ждкости, взятой на определение малонового диальдегида, мл; 3 – объем проб, взятых на фотометрию, мл; 0,156 – экстинкция 1 нмоль малонового диальдегида в 1 мл при 532 нм; Оформление работы. Рассчитать полученные результаты, дать сравнительную характеристику скорости спонтанного и индуцированного пероксидного окисления липидов, сделать вывод о возможности использования метода для оценки скорости пероксидного окисления липидов и его применимости на практике. Практическое значение работы. Методы определения скорости пероксидного окисления липидов биомембран важны для оценки действия на эту систему природных веществ и ксенобиотиков, среди которых могут быть как прооксиданты, так и антиоксиданты. Эти исследования дают возможность практически использовать выявленный эффект различных соединений, в том числе лекарственных средств. Увеличение скорости пероксидного окисления липидов возможно при старении, гиповитаминозе Е, дефиците селена, действии ионизирующего облучения, гипербарической оксигенации (действии кислорода под повышенным давлением), при некоторых заболеваниях и патологических состояниях (сердечно-сосудистых заболеваниях, гипоксии, отравлении четыреххлористым углеродом, гипервитаминозах А и D и т.д.). Гемоглобин и кислород, содержащиеся в эритроцитах, ускоряют пероксидное окисление липидов, что вызывает повреждение мембран эритроцитов и их гемолиз. Защита эритроцитарных мембран осуществляется системой антиоксидантов: токоферолами, имеющимися в мембранах и плазме крови, глутатионпероксидазой, обезвреживающей гидропероксиды липидов, и альбумином плазмы, который связывает пероксиды липидов. При недостаточности антиоксидантной системы развиваются гемолитические состояния, которые часто провоцируются некоторыми пищевыми факторами и лекарственными средствами.
ПРИЛОЖЕНИЕ
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 496; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.67.248 (0.014 с.) |