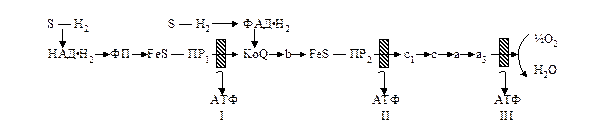Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Работа 37. Гидролиз белка ферментами пищеварительного трактаСодержание книги
Поиск на нашем сайте
Переваривание белка происходит с участием протеолитических ферментов желудка (пепсин и гастриксин) и кишечника (трипсин, химотрипсин, карбоксипептидазы А и В, аминопептидаза, эластаза и др.). Каждый из ферментов специфически гидролизует пептидные связи, образуемые определенными аминокислотами в полипептидной цепи перевариваемого белка (см. учебник, с.178-181). Оптимум рН действия протеиназ желудка находится в кислой области и равен 1,5-2,0 для пепсина и 3,0-3,5 для гастриксина, в то время как протеолитическая активность ферментов кишечника максимальна при рН 7,6-8,5. Исследование активности протеолитических ферментов проводится путем анализа скорости гидролиза добавленного белка или определения количества образующихся в ходе реакции пептидов и свободных аминокислот.
Реактивы. Фибрин*; соляная кислота, 0,05 и 0,1 М растворы; гидроксид натрия, 0,4%-ный раствор; карбонат натрия, 0,4%-ный раствор; лакмусовая бумага. Оборудование. Штатив с пробирками; пипетки вместимостью 1 и 2 мл; термостат, отрегулированный на 38˚С. Материал. 1. Пепсин, свежеприготовленный 0,1%-ный раствор в 0,05 М соляной кислоте. 2. Трипсин, кристаллический препарат во флаконах, или панкреатин, порошок. Перед употреблением готовят 0,1%-ный раствор.
а. Демонстрация гидролиза белка под действием пепсина. Метод основан на визуальном наблюдении скорости гидролиза белка пепсином, определяемой по растворению кусочков фибрина. Ход определения. Берут пять пробирок и вносят в первую 1 мл раствора пепсина, во вторую – предварительно прокипяченного раствора пепсина, в третью – раствора соляной кислоты (0,05 М), в четвертую и пятую – предварительно нейтрализованного гидроксидом натрия раствора пепсина. Во все пробирки, кроме пятой, помещают одинаковые небольшие кусочки фибрина и ставят пробы на 20-30 мин в термостат при 38˚С, после чего отмечают изменения, произошедшие с волокнами фибрина в первых четырех пробирках. Пятую пробирку охлаждают и нейтрализуют ее содержимое раствором соляной кислоты по лакмусовой бумажке. Затем приливают в пробирку 1 мл 0,1 М раствора соляной кислоты и добавляют небольшой кусочек фибрина. Пробу вновь помещают в термостат при 38˚С и через 20-30 мин отмечают изменения волокон фибрина. б. Демонстрация гидролиза белка под действием трипсина. Основа метода та же, что и при изучении действия пепсина. Ход определения. Берут три пробирки и наливают в одну из них 2 мл раствора карбоната натрия, в другую – дистиллированной воды и в третью – раствор соляной кислоты (0,1 моль/л). В первую и третью пробирки добавляют по 1 мл раствора трипсина (или панкреатина) и во вторую – 1 мл предварительно прокипяченного трипсина (или панкреатина). Перемешивают пробы встряхиванием. В каждую пробирку помещают по одинаковому кусочку фибрина и ставят их в термостат при 38˚С на 10 мин, следя за растворением фибрина. Отмечают изменения, происходящие с фибриновыми волокнами в ходе инкубации. Оформление работы. Результаты опытов оформить в виде таблицы.
В выводах указать оптимальные условия для действия изученных протеолитических ферментов и практическое значение исследований. Практическое значение работы. Переваривание белка в желудочно-кишечном тракте зависит не только от количества образующихся протеолитических ферментов, но и от условий среды, в которых они действуют. При гипохлоргидрии или анацидном гастрите имеются неблагоприятные условия (недостаток соляной кислоты) для гидролиза пищевого белка пепсином. Применение щелочных растворов (питьевая сода) при данных патологических состояниях приводит к разрушению выделяющегося клетками желудка пепсина. Напротив, гиперхлоргидрия обусловливает более медленную нейтрализацию кислого желудочного содержимого, поступающего в кишечник, и как следствие этого менее эффективную активацию проферментов и переваривающего их действия на белки и пептиды пищи.
Работа 38. Изучение динамики гидролиза триацилглицеринов под действием панкреатической липазы
Основную часть пищевых липидов составляют триацилглицерины, поэтому в переваривании жира наиболее важны условия для действия панкреатической липазы (триацилглицерол-ацилгидролаза; КФ 3.1.1.3). Этот фермент гидролизует только эмульгированный жир в слабощелочной среде. Активатором фермента служат желчные кислоты. Липаза гидролизует преимущественно концевые ацилы молекулы триацилглицерина. Образующийся 2-моноацилглицерин расщепляется карбоксиэстеразой. В качестве субстрата для изучения активности липазы используют приготовленную жировую эмульсию или молоко, в котором липиды находятся в эмульгированном состоянии.
Реактивы. Коровье молоко; желчь; гидроксид натрия, 0,1 М раствор; фенолфталеин, 0,5%-ный раствор в 76%-ном этаноле. Оборудование. Колбы вместимостью 100 мл для титрования; микробюретка; водяная баня с лабораторным термометром. Материал. Панкреатин, свежеприготовленный 5%-ный раствор на 1%-ном растворе гидрокарбоната натрия (рН≈8,0).
Метод основан на титриметрическом определении с помощью гидроксида натрия жирных кислот, освобождающихся из триацилглицеринов
молока в процессе их гидролиза панкреатической липазой в присутствии и в отсутствие желчи. Реакция протекает по уравнению
Количество образующихся жирных кислот определяется титрованием раствором гидроксида натрия с индикатором фенолфталеином. Ход определения. В три колбы отмеряют цилиндром по 25 мл коровьего молока и добавляют в первую 2 мл дистиллированной воды, во вторую и третью по 2 мл раствора панкреатина. Кроме того, в третью колбу добавляют 5 капель желчи (1 мл). Содержимое колб перемешивают и сразу отбирают по 5 мл в другие колбы для титрования (определяют исходный уровень свободных жирных кислот). Колбы с оставшейся смесью помещают в водяную баню при 37˚С и через каждые 15 мин берут по 5 мл их содержимого, переносят в колбы для титрования проб. К отобранным 5 мл инкубационной смеси в колбы прибавляют по 10 мл дистиллированной воды и по 2 капли раствора фенолфталеина. Оттитровывают их содержимое 0,1 М раствором гидроксида натрия до слабо-розовой окраски жидкости. Отмечают объем гидроксида натрия, пошедший на титрование всех проб. Оформление работы. Результаты оформить графически: по оси ординат отложить объем раствора гидроксида натрия, пошедший на титрование всех проб, а по оси абсцисс – время. По полученным на графике трем кривым (1 – без липазы; 2 – с липазой; 3 – липаза и желчь) сделать вывод об относительной скорости гидролиза триацилглицеринов под действием липазы и роли желчи в этом процессе. Практическое значение работы. При заболеваниях поджелудочной железы, в которой образуется липаза, может нарушаться переваривание жиров, и они выводятся в неизменном виде. Однако чаще всего наблюдается нарушение переваривания жиров при патологии печени и желчевыводящих путей, когда желчь либо не вырабатывается, либо не поступает в кишечник в силу препятствий в желчевыводящих путях. Поскольку желчные кислоты являются активаторами липазы, эмульгаторами жиров, а также участвуют в процессе всасывания жирных кислот, то при их отсутствии резко нарушается процесс переваривания липидов с выделением их в большом количестве с фекалиями (стеаторея). Определение активности липазы применяется в клинике после взятия кишечного сока с помощью зонда для установления причины патологии переваривания липидов. В фармации метод исследования активности липазы необходим для контроля качества лекарственных препаратов (панкреатин, фестал, панзинорм и др.), содержащих этот фермент.
ЭНЕРГЕТИЧЕСКИЙ ОБМЕН (биоэнергетика)
Существует два основных типа энергетики живых организмов – фототрофный и хемотрофный. Первым обладают растения и фотосинтезирующие микроорганизмы, которые преобразуют энергию солнечного света в энергию фосфатных связей АТФ, а вторым – клетки организмов, в том числе человека и животных, использующие для образования АТФ энергию окислительно-восстановительных реакций. Основная часть энергии в тканях человека и животных образуется аэробным путем в ходе окислительного фосфорилирования в митохондриях. Анаэробное образование энергии происходит в процессе гликолиза (гликогенолиза). Однако он играет вспомогательную роль.
Эффективность этого процесса зависит от активности дегидрогеназного звена (т.е. от наличия субстратов окисления S·H2 и активности дегидрогеназ), которое обеспечивает поступление водорода, связанного с НАД или ФАД, на дыхательную цепь митохондрий, а также от сопряжения дыхания и фосфорилирования (см. учебник с.204-214).
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 314; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |