
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние водорода на свойства сталиСодержание книги
Похожие статьи вашей тематики
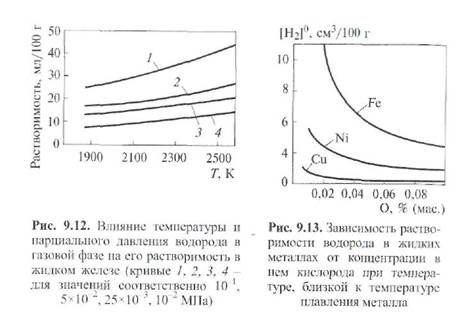
Поиск на нашем сайте Водород может оказывать на металл двоякое влияние: с одной стороны, он защищает его от насыщения кислородом и азотом, предупреждает окисление (связывая кислород), восстанавливает при известных условиях металл из оксидов, препятствует образованию нитридов железа (см. рис. 9.5); с другой стороны, водород растворяется в металле и становится причиной появления существенных дефектов в шве - пористости и трещин. Металлы, растворяющие водород, делятся на две группы: · металлы (Fe,Ni,A1, Со, Сu,Moи др.), не образующие химических соединений с водородом; · металлы (Zr,Ti,V, Та,Thи др.), образующие твердые растворы и химические соединения с водородом (гидриды). Атомарный водород растворяется как в твердом, так и в жидком железе. Как следует из рис. 9.6, б, растворимость водорода в железе с повышением температуры растет и изменяется скачкообразно в моменты полиморфных превращений. При переходе железа из твердого состояния в жидкое наблюдается резкое возрастание растворимости водорода, достигающей максимального значения при температуре ≈ 2700 К. Таким образом, наиболее значительное насыщение металла водородом при сварке происходит в процессе формирования и переноса капель с электрода в сварочную ванну.
Степень насыщения жидкого металла водородом зависит от наличия в газовой среде элементов, способных связывать водород в химические соединения, не растворимые в жидком металле и тем самым снижающие его парциальное давление в газовой среде. Так, образование в газовой среде соединений ОН и HF, не растворимых в жидком металле, снижает насыщенность металла водородом. Кроме того, весьма существенным является парциальное давление водорода в газе, контактирующем с металлом. Об этом свидетельствуют представленные на рис. 9.12 зависимости растворимости водорода в металле от температуры среды при разном его парциальном давлении (р H2) в газовой среде. Находясь в окисленном жидком металле, водород взаимодействует с кислородом по реакциям:
(квадратными скобками обозначены газы, растворенные в металле). Поэтому наличие в металле кислорода ограничивает концентрацию в нем водорода. На рис. 9.13 приведены данные о совместном растворении водорода и кислорода в жидких металлах: железе, меди и никеле. Как следует из рисунка, даже при незначительной окисленности жидкого металла резко снижается содержание в нем водорода. Насыщение водородом жидкого металла отрицательно сказывается на его свойствах. При достаточно быстром охлаждении металла сварочной ванны не весь растворенный в ней водород успевает выделиться. Особенно много водорода задерживается при снижении температуры превращения γ - α. Оставшийся в металле атомарный водород задерживается в ветвях зарождающихся и растущих дендритов, у поверхности кристаллов, у мест расположения посторонних включений, а также в микронесплошностях - скоплениях дислокаций и других дефектах кристаллического строения.»В этих местах атомы водорода соединяются в молекулы. Поэтому парциальное давление атомарного водорода в районе дефектов резко снижается, вследствие чего он продолжает диффундировать в том же направлении. Непрерывно образующийся молекулярный водород создает значительные давления, так как сам он не диффундирует через металл и практически не растворим в нем. Кроме того, водород может окисляться и образовывать водяной пар, который в металле не растворяется. В связи с тем что давление направлено во все стороны, в металле возникает объемное напряженное состояние, приводящее к снижению его пластических свойств, а иногда - к хрупкому разрушению и закалочно-водородным трещинам. Следовательно, хотя водород и не образует с металлом шва соединений, отрицательно влияющих на прочность сталей, он усиливает вредное влияние макро- и микронесплошностей, способствует резкому снижению пластических свойств и хрупкому разрушению закаленных сталей. 9.2.4 Влияние СО2, СО и паров Н2О на свойства стали Оксиды углерода СО2и СО в тех или иных количествах всегда есть в газовой среде. Степень диссоциации и окислительная способность СО2при температурах дугового разряда весьма значительны (см. рис. 9.1). В отличие от СO2окись углерода СО не диссоциирует в дуговом разряде. Кроме того, СО не растворяется в жидком металле и поэтому непосредственной опасности для него Не представляет. В то же время СО может создавать защитную атмосферу у поверхности жидкого металла, связывая кислород по реакции Окись углерода может непосредственно образовываться и при сварке угольным электродом, создавая достаточную газовую защиту. Иную роль играет окись углерода, образующаяся в самом металле при взаимодействии углерода с кислородом или углерода с оксидами металлов. В этом отношении наиболее характерна реакция между углеродом и закисью железа:
Наблюдающееся кипение металла (выделение пузырей образующейся окиси углерода) способствует удалению посторонних включений. Однако если в металле шва в момент его кристаллизации нет нужных раскислителей (например, Si,Mn), способных подавить реакцию дальнейшего образования окиси углерода, то кипение металла сварочной ванны может продолжаться до окончания кристаллизации и привести к нежелательному снижению содержания углерода, а также к образованию пор в металле шва. Пары воды диссоциируют в зоне столба дуги полностью на водород и кислород. Их влияние на свойства стали при сварке описано в разд. 9.2.3 и 9.2.1. Итак, состав газовой среды в зоне столба дуги и степень активности ее компонентов при сварке плавлением позволяет сделать общий вывод о необходимости защиты жидкой фазы сварочной ванны (стали) от контакта с воздухом и тщательной металлургической обработки ее для получения качественного сварного соединения.
|
||
|
Последнее изменение этой страницы: 2017-01-20; просмотров: 533; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.007 с.) |

 (9.22)
(9.22)
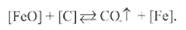 (9.23)
(9.23)


