
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Технология —«плюс-минус» водородСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1.4.1. Водород — первый элемент вселенной — становится все более популярным в технике и химической технологии. Гидрирование веществ, то есть присоединение водорода, давно применяется для производства маргарина, аммиака, синтетических горючих, полимеров. В последнее время резко возрос интерес к водороду как эффективному энергоаккумулирующему веществу. Ресурсы водорода в природе практически неисчерпаемы, поэтому заманчиво использовать его в качестве экологически чистого источника энергии. Преимущества водорода перед ископаемыми видами топлива очевидны: теплота сгорания в 3 раза выше, чем у бензина, энергии для воспламенения требуется в 15 раз меньше, а скорость распространения фронта пламени в 8 раз больше.
1.4.2. Еще недавно у специалистов по трению и износу вызывало удивление загадочное явление «намазывания» закаленной стали на бронзовую втулку в узлах трения или чугуна (у колесных ободов вагонов), на пластмассовые тормозные колодки. Причина -водородный износ, разупрочнение металла при насыщении его водородом. Теперь это «вредное» явление используют с пользой. Так, для облегчения резания легированной стали (а. с. 773 157) на ее поверхность воздействуют в присутствии меди водо-родсодержащими веществами — парами аммиака и воды, то есть обыкновенным нашатырным спиртом. В геттерных (вакуумных) водородных насосах откачивающее действие основано на поглощении газа металлом-геттером (а. с. 918510). При обработке металлов резанием используют также смазочно-охлаждающие жидкости с добавками полимеров. Под действием температуры полимерные молекулы разлагаются на углерод и водород. Углерод проникает в металл тем лучше, чем выше температура. При резании наиболее нагрета кромка инструмента — туда и устремляется углерод, упрочняя инструмент (цементация стали -известный процесс). Водород, напротив, лучше растворяется в холодных металлах: проникая в деталь, он разупрочняет верхний слой обрабатываемого металла. При водородном износе особенно активен ион водорода (протон), его размер в 100000 раз меньше, чем у ионов других элементов. Отсутствие электронной оболочки сильно облегчает взаимодействие протона с любыми молекулами. Образующиеся соединения разрушают связи, разупрочняют материалы. Как бороться с этим явлением?
Вспомним, что протон имеет положительный заряд. Если в узле трения обеспечить условия непрерывного (например, трибоэлектри-ческого) образования положительного электрического потенциала на защищаемой поверхности, то задача решается просто: в узел вводится вещество (например, пластмассовая деталь) с требуемыми свойствами. '«Вредные» свойства протона (иона водорода) нашли парадоксальное применение в новой отрасли науки и техники — ионике. Здесь все наоборот: в веществах, названных суперионными кристаллами (твердыми электролитами), носителями электричества являются не электроны, а протоны, то есть по проводам из таких материалов можно передавать протоны. Тогда в «приемнике» будут получать ионы водорода, которые соединившись с электронами, смогут образовать атомарный и далее молекулярный водород. Пока этот проект не осуществлен из-за невозможности получать достаточно длинные кристаллические нити, но уже появились первые сообщения о синтезе полимеров, обладающих протонной проводимостью при комнатной температуре («Химия и жизнь», 1986, № 6, с. 94). 1.4.3. Способность металлов поглощать водород — надежда конструкторов будущих экологически чистых «водородных» автомобилей. Экспериментальные модели поражают чистотой своего выхлопа. У водородного «Фольксвагена», занявшего первое место на международных сравнительных испытаниях, выхлопные газы оказались чище, чем всасываемый двигателем воздух. Особенно чувствителен к водороду титан и его сплавы. Например, один грамм титаномарганцевого сплава способен при давлении 30 кг/см2 поглотить 185 см3 водорода, при сбрасывании давления водород из сплава выделяется. Аналогичный эффект наблюдается у сплавов титана с железом и ванадием (а. с. 894984), никелем и ванадием (а. с. 849706). Для хранения водорода предлагают также использовать аморфный кремний (заявка ФРГ 3 110 290), калий и его сплавы (пат. США 4 327 071), скандий, цирконий, иттрий и другие (а. с. 958 317). Наиболее емкими (от 160 до" 230 см3 на один грамм гидрида) являются литий, кальций, скандий, титан, иттрий, цирконий. По степени объемного поглощения уникальным свойством обладает палладий — в одном объеме палладия при комнатной температуре растворяется 850 объемов водорода (в одном объеме воды —0,02 объема водорода).
Объемное содержание водорода в гидридах металлов выше, чем в жидком водороде. При этом для зарядки гидридов не нужны низкие температуры и компрессоры высокого давления. Выделяющийся водород особо чистый — три девятки после запятой, даже в том случае, если в гидриде аккумулировался баллонный водород с примесью кислорода, азота и влаги. Тонкие (0,1 мм) пластины из палладия свободно пропускают водород. На этом эффекте основан промышленный способ очистки ПО водорода: газ пропускают под небольшим давлением через закрытые с одной стороны палладиевые трубки, очищая от примесей.
1.4.4. При насыщении металлов водородом изменяются их физические свойства. Прежде всего увеличивается объем и уменьшается удельный вес. В романе Б. Пруса «Кукла» описаны опыты знаменитого химика Берцелиуса с наводораживанием магния. Он пытался получить слиток магния легче воздуха — летающий металл. Хотя летающие металлы н не удалось получить, но эффект «разбухания» металла нашел применение в технике. Его используют, например, при соединении деталей из разнородных материалов, которые невозможно соединить пайкой или сваркой (вольфрам и алюминий, сталь и керамика и т. д.). Титан и его сплавы увеличивают объем при гидрировании на 20 процентов — в нужном месте деталь из такого сплава образует плотное соединение. В а. с. 1 030 542 предложен способ изоляции водопри-тока в скважину, по которому в пласт вводят сплав титана с железом и закачивают водород при температуре 100—200° С. Разбухание металла начинается с поверхностных слоев, поэтому в нем возникают неравномерные механические напряжения, например: если палладиевую пластину, покрытую с одной стороны лаком, поместить в водородную среду — она изогнется, как биметаллическая пластина от нагревания. А если эту пластину использовать в качестве одного из электродов для получения водорода путем электролиза воды, то получится пульсирующий генератор водорода. При пересыщении водородом металлы разрушаются в мельчайший порошок — без шаровых мельниц и прочей механики. Гидрирование металлов изменяет и их электрические и магнитные свойства: увеличивается электропроводность, меняется в широких пределах магнитная проницаемость. Эти свойства можно использовать для контроля расхода водорода из гидридных аккумуляторов, индикации водорода (а. с. 1 024 816). Та же идея положена в основу быстродействующего датчика водорода в воздухе — водород изменяет сопротивление в палладиевом затворе канального пленочного транзистора («Техника и наука», 1985, № 9, с. 14). Наводораживание поверхностей материалов расширяет область применения акустико-эмиссионного способа контроля качества различных материалов (а. с. 1 022045). 1.4.5. Способность гидридов металлов поглощать водород при,, охлаждении и выделять при нагрев а- нии выгодно использовать там, где идут циклические или обратимые тепловые процессы. Простота и высокая надежность системы гидридного охлаждения (нет ни одной механически движущейся части) привлекла специалистов НАСА (США), разработавших систему охлаждения космических летательных аппаратов. Использована смесь металлов (интерметаллид), поглощающая в больших количествах водород при комнатной температуре. Система работает непосредственно на солнечном тепле, без преобразования его в электричество. Предполагается применять подобные системы для охлаждения в компьютерах, автомобилях, самолетных двигателях, кондиционерах воздуха.
Принцип действия таких систем основан на совместном использовании двух свойств водорода: высокой теплопроводности и способности поглощаться гидридами (или выделяться из них). Представьте себе термос, между стенками которого глубокий вакуум, а на дне — горсть гидрида. Вакуум — отличный теплоизолятор, теплопередачи между стенками нет. Теперь, если немного нагреть гидрид, то выделившийся водород станет проводником тепла между стенками. Выключим нагрев, и водород полностью поглотится гидридом, восстановится вакуум. Внутри термоса может быть аккумулятор тепла или холода. Тепловой поток может идти в любую сторону — изнутри или внутрь из внешней среды (например, зимой — отдавать). Нагревать или охлаждать гидрид (включать или выключать теплопроводность) можно принудительно (электронагрев) или за счет внешней среды (самоуправление). По энергоемкости водородные термосы в 20 раз превосходят электробатареи. В устройстве для аккумулирования холода (а. с. 903670), работающем по тому же принципу, резко снижена инерционность теплопередачи, при накоплении холода и отдаче его в охлаждаемую среду обеспечено длительное сохранение холода, имеется возможность регулирования расхода холода в широких пределах.
летом аккумулировать тепло, 1.4.6. Еще в школьном курсе химии каждый изобретатель знакомился с главным свойством водорода — восстанавливать металлы из их окисей. Изобретения, основанные на этой способности водорода, поражают своей простотой — используется всегда один и тот Же прием: если нужно получить чистый металл из его окиси, то обработай окись водородом. В новых изобретениях меняются лишь названия металлов и технологических процессов, где они используются. Впрочем, это нисколько не смущает патентных экспертов, каждый раз они находят новизну. Вот несколько примеров. Печь для археологов: для восстановления железных проржавевших изделий печь заполняют водородом и выдерживают в ней изделие при температуре 100° С.
Способ получения пористых металлических материалов (пат. ПНР 128096): порошок металла смешивают с порошком оксида того же или другого металла, прессуют заготовку требуемой формы и затем восстанавливают оксид водородом при нагревании. Способ улучшения качества отливок из металлов (пат. ФРГ 1 265 356): поверхность песчаной литейной формы и литниковой системы покрывают гидридом кальция, при контакте с заливаемым металлом выделяется водород, который тут же восстанавливает возникающие на поверхности отливки окисные пленки. Способ восстановления окислившихся частиц меди в порошковом контакте установки для непрерывного отжига стальной проволоки (Астонский университет, Англия) путем периодической подачи
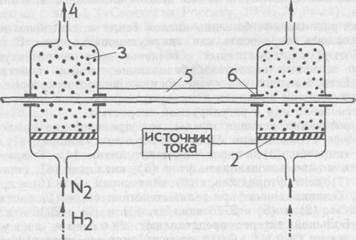
Установка для непрерывного отжига стальной проволоки: протягивание проволоки; 2 — пористая перегородка; 3 — частицы меди; 4 — на рецир-^куляцию; 5 — труба, заполненная инертным газом; 6 —уплотнители 'Зак. 137 в камеру небольших доз водорода. Пояснение: при больших скоростях подачи проволоки и больших величинах электрического тока (0,1—20 кА) не годятся угольные или металлические щетки (искрят и портят поверхность проволоки), поэтому щетки превратились в псевдожидкий слой медного порошка в камере, продуваемой азотом. 1.4.7. Из простейших безопасных способов получения водорода можно указать следующие: - смесь порошков алюминия и каустической соды (1:2) плюс вода, выход—1 м3 водорода на 1 кг алюминия и 2 кг каустической соды;
— гидрид лития плюс вода, выход—2,81 м3 водорода на 1 кг — гидрид кальция плюс вода, выход—1,06 м3 водорода на 1 кг гидрокарбонат натрия плюс вода, выход гидрида. ТЕПЛОВЫЕ КОНСЕРВЫ В ТЕХНИКЕ 1.5.1. В химических соединениях можно хранить не только ве Химики располагают большим числом веществ, способных выделять, поглощать, переносить или аккумулировать тепло. В связи с разработкой альтернативных источников энергии патентуются все новые и новые вещества, обладающие такими свойствами. 1.5.2. Есть большой класс энергоемких веществ, которые при Для протекания реакции нужны, как правило, два компонента— горючее и окислитель. Примеры горючего: водород (1), метан (2), гидразин (3), гидридоалюминат лития (4). В качестве окислителя можно использовать фтор (5), кислород (6), перекись водорода (7), пентафторид хлора (8), пентаоксид азота (9) и другие вещества. Тепловыделение при взаимодействии (1) и (5) достигает 3265 ккал/кг, (2) и (5) —2776 ккал/кг, (4) и (9) —2936 ккал/кг. 1.5.3. Большой интерес представляют способы аккуму
ческую и наоборот. Причем эти процессы могут быть многостадийными, дополнять друг друга. Поглощать тепло и выделять его в нужное время и в нужном месте — разве не заманчиво использовать эти эффекты при решении технических задач? В СССР разработан термохимический способ преобразования солнечной энергии: в реактор, нагреваемый сконцентрированными солнечными лучами, подаются метан и углекислый газ, которые в присутствии катализаторов превращаются в синтез-газ с поглощением теплоты. Затем синтез-газ сжигается в газотурбинной установке, отдавая запасенное тепло. В качестве примера можно привести и способ превращения тепловой энергии в химически связанную (предложен в заявке ФРГ 2 950 251). Он основан на разложении метилового спирта при температуре 250° С на окись углерода и водород. При обратной реакции в присутствии катализатора выделяется тепло, затраченное на первоначальную реакцию разложения. Подобный же процесс можно получить разложением сульфурила I Во многих случаях достигается более высокая плотность накапливаемой энергии, чем в механических, водяных и свинцовых электрических аккумуляторах. В Польше изобретен метод спасения терпящих кораблекрушение: если человек выпивает горячую жидкость, то он дольше держится на воде. Консервная банка с водой подогревается теплом, выделяющимся в ходе реакции между окисями кальция и алюминия, смешанными с водой («Советская Россия», 1984, 21 июля). На способности солей кальция аккумулировать тепло основана разработанная в Швеции система теплоснабжения индивидуального дома («Техника и наука», 1985, № 5, с. 37). Летом с помощью солнечного коллектора тепло запасается в контейнере с запасом соли, а зимой при подаче небольших доз воды в контейнер тепло выделяется в ходе экзотермической реакции. Срок службы системы —25 лет. 1.5.4. Разработаны дешевые и доступные легкоплавкие тепло-аккумулирующие смеси, сохраняющие свои свойства при многократном изменении фазового состояния (плавление — затвердевание). Среди них смеси на основе хлорида кальция с температурой плавления 29° С (заявки Японии 55-82182, 55-84386), гидрофосфата натрия, имеющего несколько точек фазовых переходов (заявка ФРГ 2 952 166), ксилита, плавящегося при температуре 94° С и выделяющего энергию 258 Дж/г при кристаллизации (патент США 4 295 517), гидратов солей (патент США 4 237 023) и многие другие. Английскими специалистами создан тепловой аккумулятор «Термогель» (состав теплоаккумулирующих веществ не раскры- вается), работающий на фазовом переходе: пересыщенный жидкий раствор — кристаллизация. Жидкость остается холодной до тех пор, пока в нее не введут микродозу активатора. Тут же начнется кристаллизация с активным выделением тепла. Пакет весом 0,5 кг греет 6 часов. За это время он отдает все запасенное тепло, раствор затвердевает. Для зарядки его надо снова нагреть, при этом вещество вновь становится жидким — его можно хранить очень долго без потерь энергии. Цикл «зарядка — разрядка» можно повторять сотни тысяч раз, так как в аккумуляторе нечему портиться («Социалистическая индустрия», 1985, 21 ноября). Впрочем, английский «фирменный» секрет может оказаться секретом только для взрослых, забывших школьную химию. В «Клубе
юный химик» («Химия и жизнь», 1978, № 7, с. 73—74) подробно рассказано об опыте, который каждый может проделать в домашних условиях: берется уксусно-кислый натрий (его получают из уксуса и пищевой соды) и нагревается до 58° С. При этом он плавится и остается жидким (остывая до комнатной температуры) неограниченное время. Для того чтобы вызвать кристаллизацию, в жидкость достаточно опустить маленький кристаллик той же соли. При кристаллизации выделяется запасенное тепло. Опыт можно многократно повторять. Так что английский «Термогель» скорее всего является промышленной модификацией детского химического опыта. Различные тепловые аккумуляторы получают широкое использование в быту. Например, для небольших теплиц за рубежом выпускаются аккумуляторы в виде двухлитровых коробок из черного полиэтилена, хорошо поглощающего солнечные лучи. Смесь солей в коробке плавится, запасая тепло, а при опускании температуры ниже 15° С затвердевает и медленно отдает тепло («Химия и жизнь», 1983, № 3, с. 19). В Канаде предложено размещать тепловые аккумуляторы прямо в жилой комнате — совмещать их с мебелью, стенами и т. д. («Химия и жизнь», 1978, № 6). В качестве теплоаккумулирующих веществ используются серно-кислый натрий или эфиры стеариновой кислоты (температура плавления обоих веществ близка к комнатной: 25—35° С). Веществами лучше всего пропитать пористые материалы — тогда они не будут вытекать при расплавлении. Еще дальше пошли американские химики — ими создана одежда из волокон, включающих особые пластинчатые кристаллы. Накоп- ление и высвобождение тепла происходит при перестройке структуры кристаллов — в зависимости от колебаний температуры окружающей среды («Юный техник», 1985, № 10, с. 37). 1.5.5. В японской заявке 56-136872 для быстрого охлаждения выловленной рыбы предлагается использовать эффект охлаждения воды при растворении в ней гранулированной аммиачной селитры. Температуру в этом случае удается понизить до — 5° С. Но растворять азотное удобрение — не самый лучший способ получения эффекта одноразового охлаждения. Есть вещества, которые при растворении поглощают намного больше тепла. Например, хлорид серебра (—14,8 ккал/г-моль) или хромпик (—16,7 ккал/г-•моль). 1.5.6.-Название открытия № 267 выглядит для нехимика устрашающе непонятным: «Явление волновой локализации автотормозящих твердофазных реакций». Но сущность открытого явления проста и парадоксальна — найдены условия и подобраны вещества для бескислородного саморегулирующегося горения твердых веществ, при котором нет отходов горения (газов, дыма, пепла). Это и другие новые химические явления и эффекты открыты при разработке нового метода получения тугоплавких соединений и материалов, названного самораспространяющимся высокотемпературным синтезом (СВС). При безгазовом горении в качестве горючего используют металлы (титан, цирконий, гафний, ниобий, тантал и др.), в качестве окислителя — неметаллы (бор, углерод, кремний и др.). Смесь порошков прессуют в. виде нужной детали и поджигают — по детали бежит тонкое ярко светящееся колечко (фронт волны горения). Скорость волны — несколько сантиметров в секунду. Волна доходит до противоположного края и деталь готова. В зоне горения развиваются очень высокие температуры (до 4000° К). Преимущества новой технологии (не «плавить — отливать в форму — обрабатывать», а «сжигать детали») очевидны: незначительный подвод энергии извне, простота оборудования, быстрота процесса, большая производительность, чистота продуктов. Главная особенность процесса СВС — это быстрый внутренний саморазогрев за счет высвобождения химической энергии (экзотермическая реакция). Уже изобретено свыше 200 способов получения соединений. Разработаны технологии «самовыпечки» изделий и машиностроительных деталей с заданным составом, определенной формы и размеров с нужными потребителю свойствами; технологии сварки несоединимых ранее материалов, таких, как пары графит -графит, графит — ниобий, молибден — нержавеющая сталь и т. д. Но это только начало. Открытие зарегистрировано в 1984 году (приоритет а. с. СССР 255221 от 1967 года), но уже открыты и другие -эффекты СВС: поверхностное и послойное горение, автоколебательное и спиновое (вращающееся) горение, эффекты расщепления и отражения волн горения, волновое расслоение среды.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 497; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.174.57 (0.016 с.) |



 I на двуокись серы и хлор (заявка ФРГ 2 944 926).
I на двуокись серы и хлор (заявка ФРГ 2 944 926).



