
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние атмосферных газов на свойства цветных металловСодержание книги
Поиск на нашем сайте
Медь при взаимодействии с кислородом дает стабильный оксид Сu2О, растворимый в жидкой меди:
В расплаве оксид меди Сu2О весьма устойчив, но при кристаллизации вследствие ликвации образуется эвтектика Сu- Сu2О и фаза Сu2О теряет свою устойчивость, вызывая под воздействием О2и Н2так называемую «водородную болезнь» меди, которая приводит к разрушению металла и является результатом последовательного взаимодействия меди с кислородом по реакции (9.24), а затем с водородом по следующей реакции:
И Равновесная диаграмма плавкости Сu-О приведена на рис. 9.14. Как следует из диаграммы, в области температур ниже 1065 °С (1338 К) существует раствор Сu+ Сu2О, но растворимость Сu2О в твердой фазе ничтожно мала. Таким образом, при сварке меди и ее сплавов необходимо принимать все меры для снижения степени ее окисления или вводить раскислители. Аналогичная ситуация имеет место при сварке деталей из никеля и его сплавов. Никель с О2образует два соединения:Ni2Оз иNiO. Первый из них неустойчив, является сильным окислителем (он применяется в щелочных аккумуляторах). Второй -NiO- устойчивый оксид. Он хорошо растворим в жидком никеле, но не растворим в твердом никеле. Диаграмма плавкости, приведенная на рис. 9.15, показывает, что содержащиеся в металле оксиды никеля при нагревании выше 1700 К легко диссоциируют, выделяя кислород, который образует поры с водородом, находящимся в жидком металле, при его кристаллизации. Никель, в отличие от железа, не взаимодействует с азотом, который может служить для него так же, как и для Сu, защитной средой. Титан является особо активным химическим элементом по отношению к кислороду, с которым он образует ряд устойчивых оксидов, обладающих различной степенью окисления. Кроме того, кислород растворяется в твердом металле. Оксиды, особенно имеющие низкую степень окисления: TiO,Ti2O3, ТiO2, обладают большим температурным интервалом гомогенности, т. е. существуют в однофазном твердом растворе при охлаждении до нормальной температуры (рис. 9.16).
Из оксидов титана наименьшую температуру диссоциации имеет TiО2(∆ G = 0 при 3500 К), диссоциация которого происходит согласно уравнению
Титан также активно взаимодействует с азотом и водородом (см. рис. 9.7), образуя нитриды и гидриды, поэтому требуется особо тщательная защита его сплавов от атмосферы при сварке. Алюминий соединяется с кислородом в устойчивый амфотерный оксид А12O3(корунд), образующий соли как в кислой, так и в щелочной среде. Оксид А12O3не растворим в алюминии и образует плотную оксидную пленку, имеющую весьма высокие температуру плавления (T > 2500 К) и плотность (выше, чем у металла). При сварке с окислением в шве образуются включенияAI2O3, т. е. шлаки, которые приводят к охрупчиванию металла шва. Кроме того, поверхностные пленки из А12O3склонны к адсорбции Н2O, т. е. к гидратации во влажной среде. Гидратная вода, входящая в А12O3• п Н2O, при сварке диссоциирует и это приводит к повышению парциального давления водорода в столбе дуги. При охлаждении до температуры кристаллизации растворимость водорода резко снижается практически до нулевых значений (см. рис. 9.6, а) и при кристаллизации часть выделяющегося газа создает поры в шве. Второй продукт диссоциации - кислород - окисляет основу сплава или его главный легирующий компонент (Mg,Li) и тем самым увеличивает долю шлака в шве в виде легкоплавкой эвтектики. Таким образом, попадание атмосферных газов в большей или меньшей степени в зону столба дуги вследствие несовершенства газовой защиты или в виде примесей в защитных газах оказывает вредное воздействие на конструкционные металлы и сплавы в шве и в зоне термического влияния, так как приводит к образованию в них горячих либо холодных трещин и пор, а также к снижению прочности и пластичности сварных соединений
|
||||
|
Последнее изменение этой страницы: 2017-01-20; просмотров: 375; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.177.116 (0.005 с.) |

 (9.24)
(9.24)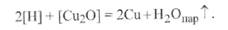 (9.25)
(9.25) ными словами, водород, растворенный в окисленном металле, взаимодействует с оксидом Сu2О, находящимся в эвтектике и восстанавливает его до Сu, но образующиеся при этом пары воды не диффундируют через металл и разрушают его по границам зерен.
ными словами, водород, растворенный в окисленном металле, взаимодействует с оксидом Сu2О, находящимся в эвтектике и восстанавливает его до Сu, но образующиеся при этом пары воды не диффундируют через металл и разрушают его по границам зерен.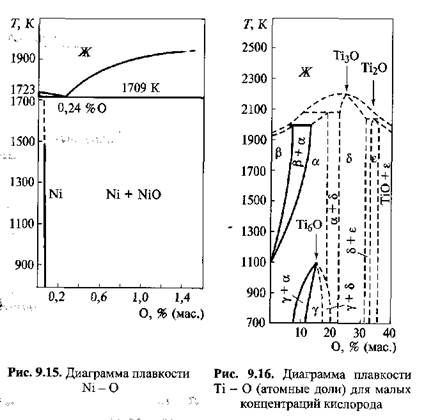 При температурах этого интервала наиболее устойчив оксид TiO. Для оксидов титана характерна ступенчатая диссоциация, которая идет по двум вариантам:
При температурах этого интервала наиболее устойчив оксид TiO. Для оксидов титана характерна ступенчатая диссоциация, которая идет по двум вариантам: (9.26)
(9.26) (9.27)
(9.27)


