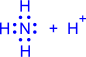Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительные свойства неметалловСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
- взаимодействие с металлами: Восстановительные свойства - взаимодействие с кислородом (исключение – фтор): Реакция диспропорционирования Характерна для активных неметаллов. Протекает в щелочной среде: Общая характеристика. Из всех известных в настоящее время элементов около 80% относятся к металлам: s-элементы I и II групп, все d- и f- элементы и ряд p-элементов главных подгрупп периодической системы. Наиболее типичные металлы расположены в начале периодов (кроме первого). Главной особенностью элементов-металлов является наличие у них на внешних энергетических уровнях небольшого числа электронов.(1,2,3). В природе металлы встречаются как в свободном виде, так и в виде соединений. В свободном виде существуют химически менее активные, трудно окисляющиеся кислородом металлы: платина, золото, серебро, ртуть, медь и др. Все металлы, за исключением ртути, при обычных условиях твердые вещества с характерным блеском, хорошо проводят электрический ток и тепло. Большинство металлов может коваться, тянуться и прокатываться. По цвету, все металлы условно подразделяются на две группы: черные и цветные. По плотности различают металлы легкие (ρ < 5) и тяжелые (ρ > 5). Примером легких металлов служат калий, натрий, кальций,алюминий и др. К тяжелым металлам относятся осмий, олово, свинец, никель, ртуть, золото, платина и т.д. Температура плавления металлов также различна: от -38.9 °С (ртуть) до 3380 °С (вольфрам). Металлы могут отличаться и по твердости: самыми мягкими металлами являются натрий и калий (режутся ножом), а самыми твердыми – никель, вольфрам, хром (последний режет стекло). Тепло и электричество различные металлы проводят неодинаково: лучшим проводником электричества является серебро, худшим – ртуть. В расплавленном состоянии металлы могут распределяться друг в друге, образуя сплавы. Большинство расплавленных металлов могут смешиваться друг с другом в неограниченных количествах. При смешивании расплавленных металлов происходит либо простое растворение расплавов одного металла в другом, либо металлы вступают в химическое соединение. Чаше всего сплавы представляют собой смеси свободных металлов с их химическими соединениями. В состав сплавов могут входить также и неметаллы (чугун – сплав железа с углеродом). Свойства металлов существенно отличаются от свойств составляющих их элементов. Известно, что у металлов на внешнем энергетическом уровне (ВЭУ) имеется 1-3 валентных электрона. Поэтому они сравнительно легко отдают свои электроны неметаллам, у которых на ВЭУ 5-7 электронов. Так, металлы непосредственно реагируют с галогенами. Большинство Ме хорошо реагируют с кислородом (исключая золото, платину, серебро), образуя оксиды и пероксиды; взаимодействуют с серой с образованием сульфидов. Щелочные ищелочноземельные металлы легко реагируют с водой с образованием растворимых в ней щелочей. Металлы средней активности реагируют с водой только при нагревании. Малоактивные металлы с водой вообще не реагируют. Большинство металлов растворяется в кислотах. Однако химическая активность различных металлов различна. Она определяется легкостью атомов металла отдавать валентные электроны.
Квантовые числа электрона Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He +, Li 2+ и т. д.). В этом случае энергия электрона
n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном. В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Орбитальное квантовое числоl характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
Электроны с одинаковым значением l образуют подуровень. Квантовое число l определяет квантование орбитального момента количества движения электрона Квантовое число m l называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от – l до + l через нуль, то есть 2 l + 1 значений. Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения M z на какую-либо ось координат (обычно ось z):
Все вышесказанное можно представить таблицей:
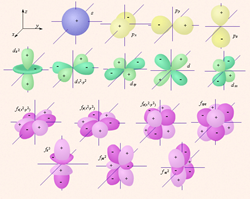
Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p -орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены. Граничные поверхности s -, p -, d -, f - орбиталей показаны на рис. 2.1.
s -Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μ l = 0. p -Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: m l = –1, 0, +1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются p x, p y, p z. d -Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором m l = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d -Орбитали, ориентированные лопастями по осям координат, обозначаются d z ² и d x ²– y ², а ориентированные лопастями по биссектрисам координатных углов – d xy, d yz, d xz. Семь f -орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, приведенных на рис. 2.1. Квантовые числа n, l и m l не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое числоm s имеет только два значения m s = ±1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными m s обозначаются стрелками, направленными вверх В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырех квантовых чисел, однако в этом случае электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, а вернее их суммой: энергия атомных орбиталей возрастает по мере увеличения суммы n + l; при одинаковой сумме сначала заполняется уровень с меньшим n и большим l. Энергия атомных орбиталей возрастает согласно ряду
Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии. Современная формулировка периодического закона такова: Таблица Менделеева Периодическая таблица Менделеева состоит из 8 групп и 7 периодов. Вертикальные столбцы таблицы называют группами. Элементы, внутри каждой группы, обладают сходными химическими и физическими свойствами. Это объясняется тем, что элементы одной группы имеют сходные электронные конфигурации внешнего слоя, число электронов на котором равно номеру группы. При этом группа разделяется на главные и побочные подгруппы. В Главные подгруппы входят элементы, у которых валентные электроны располагаются на внешних ns- и np- подуровнях. В Побочные подгруппы входят элементы, у которых валентные электроны располагаются на внешнем ns- подуровне и внутреннем (n — 1) d- подуровне (или (n — 2) f- подуровне). Все элементы в периодической таблице, в зависимости от того, на каком подуровне (s-, p-, d- или f-) находятся валентные электроны классифицируются на: s- элементы (элементы главной подгруппы I и II групп), p- элементы (элементы главных подгрупп III — VII групп), d- элементы (элементы побочных подгрупп), f- элементы (лантаноиды, актиноиды). Высшая валентность элемента (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится. Для элементов главных и побочных подгрупп одинаковыми являются формулы высших оксидов (и их гидратов). В главных подгруппах состав водородных соединений являются одинаковыми, для элементов, находящихся в этой группе. Твердые гидриды образуют элементы главных подгрупп I — III групп, а IV — VII групп образуют а газообразные водородные соединения. Водородные соединения типа ЭН4 – нейтральнее соединения, ЭН3 – основания, Н2Э и НЭ — кислоты. Горизонтальные ряды таблицы называют периодами. Элементы в периодах отличаются между собой, но общее у них то, что последние электроны находятся на одном энергетическом уровне (главное квантовое числоn — одинаково ). Первый период отличается от других тем, что там находятся всего 2 элемента: водород H и гелий He. Во втором периоде находятся 8 элементов (Li — Ne). Литий Li – щелочной металл начинает период, а замыкает его благородный газ неон Ne. В третьем периоде, также как и во втором находятся 8 элементов (Na — Ar). Начинает период щелочной металл натрий Na, а замыкает его благородный газ аргон Ar. В четвёртом периоде находятся 18 элементов (K — Kr) – Менделеев его обозначил как первый большой период. Начинается он также с щелочного металла Калий, а заканчивается инертным газом криптон Kr. В состав больших периодов входят переходные элементы (Sc — Zn) — d- элементы. В пятом периоде, аналогично четвертому находятся 18 элементов (Rb — Xe) и структура его сходна с четвёртым. Начинается он также с щелочного металла рубидий Rb, а заканчивается инертным газом ксенон Xe. В состав больших периодов входят переходные элементы (Y — Cd) — d- элементы. Шестой период состоит из 32 элементов (Cs — Rn). Кроме 10 d -элементов (La, Hf — Hg) в нем находится ряд из 14 f -элементов(лантаноиды)- Ce — Lu Седьмой период не закончен. Он начинается с Франций Fr, можно предположить, что он будет содержать, также как и шестой период, 32 элемента. Но найдено пока только 24 (до элемента с Z = 110). Сюда входят 14 f -элементов, которые относятся к актиноидам. Периодический закон Менделеев дал следующую формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса». Правило октета утверждает, что все элементы стремятся приобрести или потерять электрон, чтобы иметь восьмиэлектронную конфигурацию ближайшего благородного газа. Т.к. внешние s- и p-орбитали благородных газов полностью заполнены, то они являются самыми стабильными элементами. Сродство к электрону – изменение энергии при приобретении дополнительного электрона атомом вещества в газообразном состоянии. При движении по группе вниз сродство к электрону становится менее отрицательным вследствие эффекта экранирования. атомный радиус. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. При изучении строения молекул и кристаллов атомы и ионы можно рассматривать как имеющие некий эффективный радиус, зависящий от типа химической связи. Если рассматривать только относительные величины атомных радиусов, то легко обнаружить периодичность их зависимости от номера элемента. В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром. В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек. У s - и p -элементов изменение радиусов как в периодах, так и в подгруппах более ярко, чем у d - и f -элементов, поскольку d - и f -электроны внутренние. Уменьшение радиусов у d - и f-элементов в периодах называется d - и f -сжатием. Следствием f -сжатия является то, что атомные радиусы электронных аналогов d -элементов пятого и шестого периодов практически одинаковы Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона. Энергия ионизации I выражается в кДж∙моль–1 или эВ∙атом–1. Значение I в электронвольтах численно равно потенциалу ионизации, выраженному в вольтах, поскольку E = e -· I. Э+ – e– = Э+, Δ H = I 1 – первый потенциал ионизации; Э – e– = Э2+, Δ H = I 2 – второй потенциал ионизации и т.д. I 1 < I 2 < I 3 < I 4... Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов. Энергия сродства к электрону. Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону E значительно сложнее, чем определение энергии ионизации. Величины E (в эВ) для некоторых атомов приведены ниже:
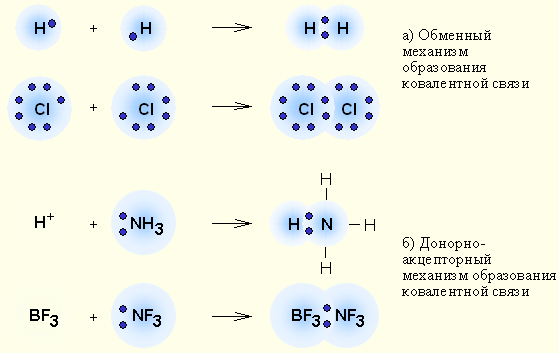
Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных подоболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы). Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют. Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s 2 и s 2 p 6 и переходные элементы. У остальных элементов в таблице Менделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх. В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов. В главных и побочных подгруппах свойства элементов меняются немонотонно, что обусловлено так называемой вторичной периодичностью, связанной с влиянием d - и f -электронных слоев. Из анализа периодичности геометрических и энергетических параметров атомов следует, что периодическим законом можно пользоваться для определения физико-химических констант, предсказывать изменение радиусов, энергий ионизации и сродства к электрону, и, следовательно, кислотно-основные и окислительно-восстановительные свойства их соединений. Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
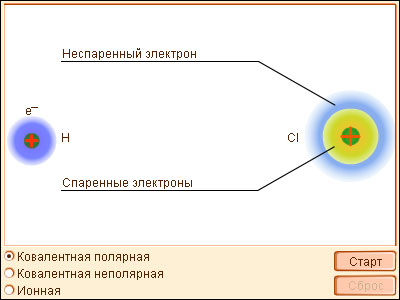
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль–1. При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA– χB)2, где χA и χB – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь пойдет ниже (см. метод валентных связей). Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент~3∙10–29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–. Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
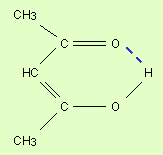
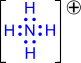
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3). Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С. Ван-дер-ваальсова (межмолекулярная) связь – наиболее универсальный вид межмолекулярной связи, обусловлен дисперсионными силами (индуцированный диполь – индуцированный диполь), индукционным взаимодействием (постоянный диполь – индуцированный диполь) и ориентационным взаимодействием (постоянный диполь – постоянный диполь). Энергия ван-дер-ваальсовой связи меньше водородной и составляет 2–20 кДж∙моль–1.
Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной. Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной. Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-07; просмотров: 2345; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.131.51 (0.018 с.) |

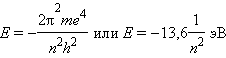
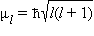 в сферически симметричном кулоновском поле ядра.
в сферически симметричном кулоновском поле ядра.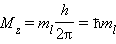
 и вниз
и вниз 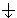 .
.