
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теория мономолекулярной адсорбции Ленгмюра.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Теория мономолекулярной адсорбции, которую разработал американский химикИ. Ленгмюр, основывается на следующих положениях. 1) Адсорбция является локализованной и вызывается силами, близкими к химическим. 2) Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, которыми являются выступы либо впадины на поверхности адсорбента, характеризующиеся наличием т.н. свободных валентностей. Активные центры считаются независимыми (т.е. один активный центр не влияет на адсорбционную способность других), и тождественными. 3) Каждый активный центр способен взаимодействовать только с одной молекулой адсорбата; в результате на поверхности может образоваться только один слой адсорбированных молекул. 4) Процесс адсорбции является обратимым и равновесным – адсорбированная молекула удерживается активным центром некоторое время, после чего десорбируется; т.о., через некоторое время между процессами адсорбции и десорбции устанавливается динамическое равновесие.
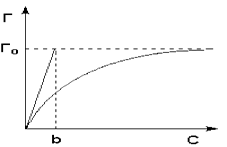
Уравнение Фрейндлиха. Г. Фрейндлих показал, что при постоянной температуре число молей адсорбированного газа или растворенного вещества, приходящееся на единицу массы адсорбента (т.н. удельная адсорбция x/m), пропорционально равновесному давлению (для газа) или равновесной концентрации (для веществ, адсорбируемых из раствора) адсорбента, возведенным в некоторую степень, которая всегда меньше единицы:
Рис. 4.7 Изотерма адсорбции Фрейндлиха в обычных (а) и логарифмических (б) 73. Правило Шилова. По эмпирическому правилу Шилова, чем лучше вещество растворяется в данном растворителе, тем хуже оно из этого растворителя адсорбируется. В более общем виде эту закономерность можно сформулировать: полярные адсорбенты лучше адсорбируют полярные адсорбтивы из неполярных растворителей, а неполярные адсорбенты –неполярные адсорбтивы из полярных растворителей. 74. Что изучает коллоидная химия? Дать понятие о дисперсной системе, степени дисперсности? КОЛЛОИДНАЯ ХИМИЯ, область химии, изучающая дисперсные системы и поверхностные явления, возникающие на границе раздела фаз. Диспе́рсная систе́ма — это образования из двух или большего числа фаз (тел), которые практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.). Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза. Степень раздробленности, или дисперстности, частиц ДФ в значительной мере определяет свойства дисперстных систем. Количественно дисперсность характеризуеться линейными размерами частиц ДФ: чем меньше размеры частиц, тем больше дисперсность и наоборот.
|
||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 961; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.20.13 (0.011 с.) |



 (а)
(а)
 (б)
(б)



