
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физическая сущность адсорбцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Адсорбцией называется процесс поглощения газов (паров) или жидкостей поверхность твердых тел (адсорбентов). В случае избирательного поглощения компонентов смеси появляется возможность ее разделения на составляющие компоненты. Явление адсорбции связано с наличием сил притяжения м/у молекулами адсорбента и поглощаемого вещества. Твердое вещество, на поверхности или в порах которого происходит концентрирование поглощаемого вещества, называется адсорбентом. Поглощаемое вещество, находящееся вне пор адсорбента, называется адсорбтивом, а после его перехода в адсорбированное состояние – адсорбатом. Адсорбция – физ. и хим. При физической адсорбции молекулы поглощенного вещества, находящиеся на поверхности адсорбента, не вступают с ним в химическое взаимодействия. Связь молекул поглощенного вещества (адсорбата) с адсорбентом при физической адсорбции менее прочна, чем при хемосорбции. Физ. адсорбция явл-ся экз. пр-сом. Q адсорбции из газов и паров примерно равно теплоте их конденсации, теплота адсорбции из р-ров несколько меньше. Пр-с адсорбционного разделения прекращается, когда активная поверхность (или объем пор) адсорбента оказывается заполненной молекулами адсорбата. Выделение из адсорбента поглощенных комп-ов называется десорбцией. Если в слой адсорбента ввести сравнительно небольшое количество разделяемой смеси, адсорбироваться будут все ее компоненты. Это происходит до тех пор, пока вся активная поверхность адсорбента не будет заполнена. Дальнейшее поступление исходной смеси в слой адсорбента приведена к тому, что молекулы, отличающиеся более высокой адсорбируемостью, будут частично вытеснять с поверхности адсорбента молекулы вещества с меньшей адсорбируемостью и установиться равновесие между адсорбированной и неадсорбированной средами. При прохождении исходной смеси через определенный слой адсорбента, рассмотренный выше процесс протекает послойно в направлении движения исходной разделяемой смеси. Адсорбционное разделение в данном слое адсорбента будет завершено, когда в потоке, выходящем из слоя адсорбента, появится компонент, подлежащий извлечению из исходной смеси, т.е. когда в соответствии с состоянием равновесия активная поверхность адсорбента заполнится извлекаемым компонентом и произойдет «проскок» этого компонента с уходящим потоком. Исчерпание адсорбционной способности – проскок определяет время защитного действия адсорбента по соотношению к данному компоненту. Кол-во вещества, адсорбируемого поверхностью, определяется состоянием равновесия и природы адсорбента и адсорбируемого вещества, концентрации последнего в исходной смеси, температуры процесса, а при адсорбции газовой фазы и от давления. В результате адсорбции концентрация поглощаемого вещества в потоке уменьшается по мере перемещения его через слой адсорбента. Поэтому и количество (концентрация) адсорбируемого вещества по высоте слоя адсорбента также изменяется в пределах от максимального до минимального, соответствующего состоянию равновесия с потоком, покидающим слой адсорбента. Возможность разделения той или иной смеси методом адсорбции зависит от величины адсорбируемости компонентов, входящих в ее состав. Адсорбируемость веществ зависит от их природы, строение структуры адсорбента (величины удельной поверхности, размеров пор и т.п.). Изотерма адсорбции Равновесное состояние при адсорбции характеризуется изотермой адсорбции, она связывает количество адсорбированного единицей массы адсорбента вещества, т.е. активность (в массовых, мольных или объемных единицах) с концентрацией или парциальным давлением (в случае газовой фазы) компонента разделяемой смеси при данной температуре. Обычно изотермы адсорбции строят на основании экспериментальных данных.
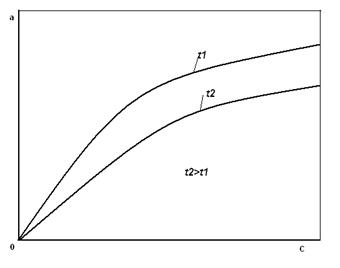
Рис.1. общий вид изотермы адсорбции при разных температурах. На рис.1 приведены типичные изотермы адсорбции для двух температур. Из анализа этих кривых следует, что активность адсорбента возрастает с увеличением концентрации или парциального давления) адсорбируемого компонента и с понижением температуры процесса. Для описания изотермы адсорбции наибольшее распространение получили: Уравнение Лэнгмюра Уравнение Фрейндлиха где а – активность (емкость) адсорбента; с - концентрация или парциальное давление адсорбируемого компонента; А1, А2,b, d – коэффициенты и показатели степени, зависящие от природы адсорбента и адсорбата, а так же от температуры.
|
||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 1291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.006 с.) |

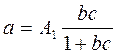
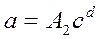 ,
,


