
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Как зависит кислотность от природы растворителя?Содержание книги
Поиск на нашем сайте
Растворители оказывают сильное влияние на стабилизацию образующегося аниона (эффект сольватации). Лучше гидратируются небольшие по размеру ионы с низкой степенью делокализации заряда. Например, в ряду карбоновых кислот с увеличением длины алифатического (гидрофобного) радикала кислотность уменьшается.
33.Почему реакция натрия со спиртом идет медленнее, чем с водой? Нужно отметить, что реакция между спиртом и натрием протекает не так энергично, как реакция натрия с водой. Еще медленнее действуют на спирт другие металлы, сравнительно легко вытесняющие водород из воды, как, например, кальций. Таким образом, кислотные свойства у спирта выражены слабее, чем у воды. 34. почему вода разлагает этилат натрия?
СН3-СН2-О(-) + Н-О-Н -----> СН3-СН2-О-H + Н-О(-). Реакция свелась к тому, что этилат-анион "оторвал" протон от молекулы воды. Можно трактовать и иначе: будучи более сильной кислотой, чем этанол, вода передает свой протон этилат-аниону, при этом сама превращается в гидроксид-анион. Таким образом, это самая обычная кислотно-основная реакция: более сильная кислота (вода) вытесняет более слабую кислоту (этанол) из ее соли (этилат натрия можно и нужно рассматривать как соль).
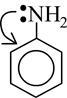
35. Основность диэтиламина и анилина Диэтиламин. Анилин (C2H5)2NH. Из-за наличия в молекулах неподеленной пары электронов амины, как и аммиак, проявляют основные свойства. В ряду анилин аммиак первичный амин вторичный амин основные свойства усиливаются, из-за влияния типа и числа радикалов. Следовательно диэтиламин более сильное основание,чем анилин. 36 общая характеристика реакционной способности гетерофунсоединений. Кислотно-основная свойства. Вещества природного происхождения часто представлены гетерофункциональными соединениями, поскольку они включают сочетание различных функциональных групп - карбоксильной, гидроксильной, карбонильной, аминогруппы и др. Не исключено, что при этом в молекуле может быть и несколько одинаковых функциональных групп. В первом приближении химические свойства гетерофункциональных соединений представляют собой сумму свойств, обусловленных каждой группой в отдельности. Однако во многих случаях наличие двух (или более) различных функциональных групп приводит к усилению или ослаблению свойств, присущих монофункциональным соединениям, и, что важнее, порождает специфические химические свойства, присущие только гетерофункциональным соединениям. Кислотность гидроксикислот выше, чем незамещённых карбоновых кислот. Это обусловлено электроноакцепторным действием гидроксильной группы (-I-эффект), и чем ближе она к кислотному центру, тем это влияние сильнее. Так, pKa молочной кислоты на порядок выше, чем пропановой кислоты (3,9 и 4,9 соответственно). Аминокислоты содержат одновременно кислотную (СООН) и основную (NH2) группы. Привычное написание формул аминокислот как соединений, содержащих амино- и карбоксильную группу, например RCH(NH2)COOH, является условным и не отражает их истинного строения. Как в кристаллическом состоянии, так и в среде, близкой к нейтральной, аминокислоты существуют в виде внутренней соли - диполярного иона, называемого также цвиттер-ионом (от нем. Zwitter - смешанный тип). В сильнокислой среде в аминокислотах полностью протонирована аминогруппа (катионная форма) и не диссоциирована карбоксильная группа. В сильнощелочной среде, напротив, не протонирована аминогруппа, а карбоксильная группа полностью ионизирована (анионная форма) 37. Гетерофункциональный заместитель как фактор, влияющий на химические свойства реакционного центра. Специфические реакции гетерофункциональных соединений.
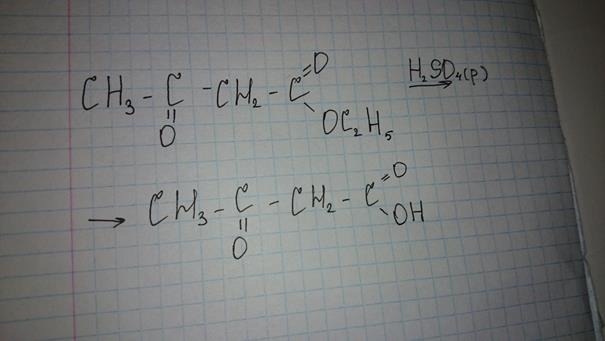
38.биологически важные классы гетерофункциональных соединений и их свойства. Ненасыщенные Карбоновые кислоты. Оксикислоты, аминокислоты, оксокислоты. Напишите реакцию взаимодействия ацетоуксусного эфира и серной кислоты. Среди гетерофункциональных соединений в природных объектах наиболее распространены аминоспирты, аминокислоты, гидроксикарбонильные соединения, а также гидрокси- и оксокислоты. Одноосновные непредельные кислоты содержат ненасыщенный углеводородный радикал, связанный с карбоксильной группой. Общая формула таких кислот (с одной двойной связью) имеет вид С Н2п- СООН. В молекуле ненасыщенных карбоновых кислот могут содержаться две и более этиленовых связей, а также тройная связь. Примерами таких кислот могут быть акриловая кислота СН2=СН—СООН, метакриловая кислота СН2=С(СНз)—СООН, кротоновая кислота СНз—СН=СН—СООН, пропиновая кислота СН=С—СООН, а также высшие ненасыщенные кислоты (олеиновая, линолевая и линоленовая). Оксокислотами называют соединения, содержащие в молекуле одновременно карбоксильную и альдегидную (или кетонную) группы. В соответствии с этим различают альдегидокислоты и кетонокислоты. Простейшей альдегидокислотой является глиоксалевая (глиоксиловая) кислота, которая обычно существует в виде гидрата (НО)2СНСООН. Она содержится в недозрелых фруктах, но по мере созревания ее количество уменьшается.Гидроксикислотами называют соединения, содержащие в молекуле одновременно гидроксильную и карбоксильную группы. Аминокислоты содержат в молекуле аминогруппу и карбоксильную группу. В алифатическом ряду по взаимному расположению функциональных групп различают α-, β-, γ- и т. д. гидрокси- и аминокислоты. Буквой греческого алфавита указывают положение другой функциональной группы относительно карбоксильной, при этом отсчет ведется от ближайшего к карбоксильной группе атома углерода, т. е. от атома С-2. Отметим, что в заместительной номенклатуре для замещенных карбоновых кислот локанты α-, β-, γ- и т. д. не употребляются.
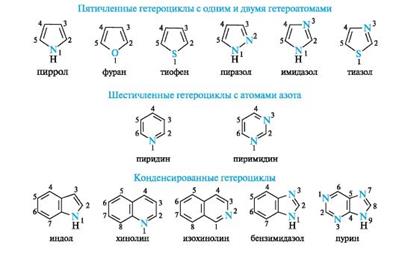
39. Биологически важные гетероциклические системы. Пятичленные гетероциклы с одним гетероатомом. Пиролл, фуран, тиофен. Понятие о строение тетрапирольных соединений. Линейные тетрапирольные соединения. Наиболее важные гетероциклы, составляющие основу многих природных биологически активных веществ и лекарственных средств, приведены на схеме
70. Правило Дюкло-Траубе — зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 раза. 71. Теория Ленгмюра базируется на следующих положениях: 1). Основное положение теории Лэнгмюра:поверхность адсорбента ограничена. Адсорбция вещества происходит не на всей поверхности, а только на активных центрах. Такими центрами могут служить отдельные атомы или группы атомов, выступающих над поверхностью адсорбента. 2). Каждый активный центр удерживает только одну молекулу. 3). Когда все активные центры заняты и поверхность адсорбента покрыта слоем толщиной в одну молекулу (мономолекулярный слой), наступает адсорбционное равновесие и дальнейшее увеличение адсорбции невозможно. 4). Процесс адсорбции имеет динамический характер. При равновесии скорость адсорбции и десорбции одинакова. Адсорбированные молекулы остаются некоторое время связанными с активными центрами, а затем покидают поверхность (десорбируются) и их место занимают другие молекулы Время пребывания молекулы на активном центре зависит от температуры. 5). Адсорбированные на активных центрах молекулы не взаимодействуют друг с другом. Уравнение изотермы мономолекулярной адсорбции Ленгмюра имеет вид:
где А и А¥ соответственно величина адсорбции газа или пара при данном и предельном заполнении монослоя; К – константа адсорбционного равновесия Это уравнение характеризует интенсивность взаимодействия адсорбента и адсорбата. Для адсорбции веществ из растворов справедливо уравнение
где Г – Гиббсовская адсорбция при концентрации С; Г¥– максимальная или предельная адсорбция, соответствующая образованию монослоя, С – равновесная концентрация вещества в растворе. Зависимость величины адсорбции от концентрации представлена на следующем рисунке
В координатах С / Г — С получаем прямую, и из графика находим величины Г ¥и К (рис. 1). Зная опытное значение Г ¥, можно рассчитать площадь поперечного сечения молекулы и ее длину. 74. КОЛЛОИДНАЯ ХИМИЯ, область химии, изучающая дисперсные системы и поверхностные явления, возникающие на границе раздела фаз. Диспе́рсная систе́ма — это образования из двух или большего числа фаз (тел), которые практически не смешиваются и не реагируют друг с другом химически. Дисперсность — физическая величина, характеризующая размер взвешенных частиц в дисперсных системах. Это величина, показывающая какое число частиц можно уложить вплотную в одном кубическом метре.
|
||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 1045; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.42.233 (0.006 с.) |

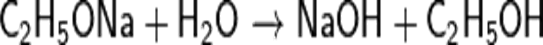


 д
д



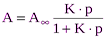 , (1)
, (1)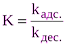 , р – равновесное давление газа или пара.
, р – равновесное давление газа или пара.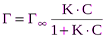 , (2)
, (2)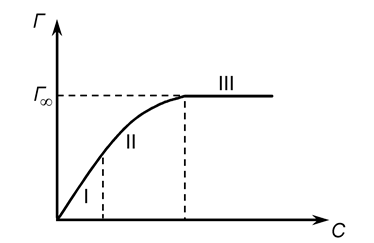 Для экспериментальной проверки применимости уравнения Ленгмюра и нахождения постоянных Г¥и К, уравнение Ленгмюра преобразовывают следующим образом. Делим единицу на левую и правую части уравнений (1), (2), получим:
Для экспериментальной проверки применимости уравнения Ленгмюра и нахождения постоянных Г¥и К, уравнение Ленгмюра преобразовывают следующим образом. Делим единицу на левую и правую части уравнений (1), (2), получим: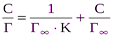 , (3)
, (3)


