Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотно-основное равновесие. Современные представления о кислотно-основных равновесиях.Содержание книги
Поиск на нашем сайте Кислотно-основное равновесие – относительное постоянство реакции внутренней среды организма, количественно характеризующееся или концентрацией водородных ионов (протонов), выраженной в молях на 1 л, или водородным показателем – отрицательным десятичным логарифмом этой концентрации – рН (power hydrogen – сила водорода).
БИОХИМИЯ 1) атомы в молекулах соединены друг с другом согласно их валентности, порядок распределения связей в молекуле называется химическим строением;
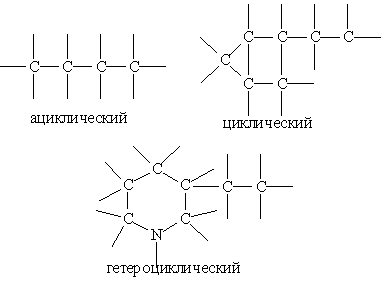
2)Органические соединения отличаются своей многочисленностью и разнообразием. Органические соединения классифицируют, учитывая два основных признака: -строение углеродного скелета -наличие и строение функцианальных групп. Углеродные скелеты разделяют на ациклические (не содержащие циклов), циклические и гетероциклические.
В гетероциклическом скелете в углеродный цикл включается одни или несколько атомов, отличных от углерода. Исторически сложилась традиция не рассматривать такие гетероатомы как функциональные группы, а считатьих частью углеродного скелета. В самих углеродных скелетах нужно классифицировать отдельные атомы углерода по числу химически связанных с ними атомов углерода. Если данный атом углерода связан с одним атомом углерода, то его называют первичным, с двумя — вторичным, тремя — третичным и четырьмя — четвертичным. Поскольку атомы углерода могут образовывать между собой не только одинарные, но и кратные (двойные и тройные) связи, то соединения, содержащие только одинарные связи углерод—углерод, называют насыщенными, соединения с кратными углерод¾ углеродными связями называют ненасыщенными. Соединения, в которых атомы углерода связаны только с атомами водорода, называют углеводородами. 1. Природа функциональной группы Функциональные группы, содержащие атом кислорода: · гидроксильная –ОН, · карбонильная >С=O · карбоксильная –COOH · алкоксильная –OR (типа –ОСН3) и др. 2Функциональные группы, содержащие атом азота: · аминогруппа –NH2 · нитрогруппа –NO2 · нитрозогруппа –NO · нитрильная группа или цианогруппа –CN · гидразинная –NHNH2 · амидная –CONH2 и др. 3Функциональные группы, содержащие атом серы · тиольная (сульфгидрильная, меркапто-) –SH · сульфидная >S · дисульфидная –S–S– · сульфоксидная >S=O, · сульфонная >SO2 и др. 4Функциональные группы, содержащие ненасыщенные углерод-углеродные связи: · двойные и тройные связи (в том числе сопряжённые диеновые системы) –С=С–, –С≡С– · ароматические фрагменты –С6H5 и др. 5Функциональные группы, содержащие прочие атомы: · атомы металлов –Li · атомы галогенов –Cl, и др.
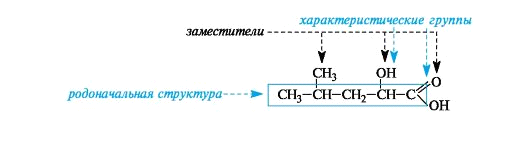
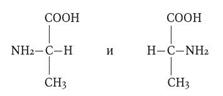
Функциональная группа- атом или группа атомов, определяющие принадлежность соединения к определенному классу и ответственные за его химические свойства. Структурная формула — изображение химических связей между атомами в молекуле с учетом их валентности. Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением. 3) номенклатура IUPAC — международная единая химическая номенклатура. Систематическая номенклатура основывается на современной теории строения и классификации органических соединений и пытается решить главную проблему номенклатуры: название каждого органического соединения должно содержать правильные названия функций (заместителей) и основного скелета углеводорода и должно быть таким, чтобы по названию можно было написать единственно правильную структурную формулу. Родоначальная структура – главная углеродная цепь или циклическая структура в карбо- и гетероциклах. Углеводородный радикал – остаток формульного обозначения углеводорода со свободными валентностями (см. таблицу 2). Характеристическая группа – функциональная группа, связанная с родоначальной структурой или входящая в ее состав (см. таблицу 3). Основные принципы номенклатуры IUPAC следующие: 1. За основу названия берется самая длинная углеводородная цепь, включающая обычно старшую функциональную группу, с добавлением в суффиксе родового окончания, соответствующего последней. 2. Атомы углерода в цепи нумеруются последовательно с того конца, к которому ближе расположена старшая функциональная группа, но предпочтение при прочих равных условиях отдается двойной, затем тройной связи. 3. К основу названия добавляются, начиная с простейшего, названия заместителей, при необходимости – с указанием их количества при помощи приставок умножения ди-, тетра-, пента- и т.д. При этом для каждого заместителя указывают его место в цепи, т.е. номер атома, к которому присоединен заместитель в сквозной нумерации. Положение и название заместителей и, при необходимости, функциональных групп указывают в префексе перед названием цепи, отделяя цифры дефисом. Для функциональных групп цифры ставят перед их названием или после названия, отделяя их в суффиксе также дефисом. 4. Названия заместителей (радикалов) могут быть системные и тривиальные. Алкильные радикалы называют, изменяя окончание – ан на –ил в названии соответствующего алкана. Обычно в названии радикала отражается тип атома углерода, имеющего свободную валентность. Атом углерода, связанный с одним углеродным атомом, называется первичным (-СН3), с двумя – вторичным (СН3СН2СН3), с тремя – третичным (СН(СН3)3), с четырьмя – четвертичным (С(СН3)4). 5. Если в названии необходимо указать несколько заместителей, то они даются в порядке возрастания старшинства или по алфавиту. При перечислении суффиксов в первую очередь указывают двойную, затем тройную связи.
4).Родоначальная структура - химическая структура, составляющая основу называемого соединения. В ациклических соединениях в качестве родоначальной структуры рассматривается главная цепь атомов углерода, в карбоциклических и гетероциклических соединениях - цикл. Характеристическая группа - функциональная группа, связанная с родоначальной структурой или частично входящая в ее состав. Заместитель - любой атом или группа атомов, замещающие в ор- ганическом соединении атом водорода.
5. Основные классы биологически важных органических соединений: спиртов, фенолов, тиолов, аминов, простых эфиров, сульфидов, альдегидов, кетонов, карбоновых кислот. Органические радикалы.
функциональной группы и радикалов- заместителей 4) Конформационная изомерия - такая изомерия, где молекулы переходят друг в друга за счет свободного вращения атомов вокруг связей. Например «ванны» и «кресла».
К электронным эффектам относятся: индуктивный эффект, мезомерный эффект. Индуктивным эффектом называется смещение электронной плотности σ-связей вдоль линии связи, вызванное различием в значениях электроотрицательности атомов. Индуктивный эффект может быть положительным и отрицательным.
Атомная орбиталь – это функция, которая описывает плотность электронного облака в каждой точке пространства вокруг ядра атома. При определении геометрической формы химической частицы следует учитывать, что пары внешних электронов центрального атома, в том числе и не образующие химическую связь, располагаются в пространстве как можно дальше друг от друга. Иногда используют понятие о гибридизации орбиталей центрального атома - выравнивание их энергии и формы. Гибридизация применяется для квантово-химического описания перестройки орбиталей в химических частицах по сравнению со свободными атомами. Сущность гибридизации атомных орбиталей состоит в том, что электрон вблизи ядра связанного атома характеризуется не отдельной атомной орбиталью, а комбинацией атомных орбиталей с одинаковым главным квантовым числом. Такая комбинация называется гибридной орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии атомные орбитали, занятые электронами. 10. Структурная и пространственная изомерии. Пространственная изомерия - это существование изомеров, имеющих одинаковый состав и порядок соединения атомов, но отличающихся характером расположения атомов или групп атомов в пространстве относительно друг друга.Бывает: Изомерию углеродного скелета 11. Конфигурация и конформация Пространственные изомеры делятся на два вида: конформационные и конфигурационные. Конфигурации – это порядок расположения атомов в пространстве без учета различий, которые возникают в результате вращения вокруг одинарных связей. Эти изомеры существуют в виде различных конформаций. Конформации – очень неустойчивые динамические формы одной и той же молекулы, которые возникают в резцльтате вращения атомов или групп атомов вокруг одинарных связей, в результате чего атомы занимают различное пространственное положение. Каждая конформация молекулы характеризуется определённой конфигурацией.
19. Сравните кислотность этиленгликоля и этанола. Кислотность этиленгликоля выше, чем у этанола.Благодаря более выраженным кислотным свойствам многоатомные спирты реагируют с Сu(OH)2, образуя растворимые комплексные соединения – хелаты.
|
||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 651; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.008 с.) |


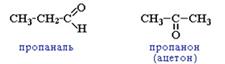

 ,
,